2023年3月份恶性上皮瘤与血管类疾病领域新开临床试验数量单月增幅最高
- 2023-04-18 14:57
- 作者:陈宇哲
- 来源:中国食品药品网
根据美国 Clinicaltrial 数据库数据,2023年3月份,全球新增由企业资本主导的临床试验总数为884项,新开临床试验数量上升,较2月份上升39.65%。单月新增临床试验数量显著高于2022年同期水平,相较于2022年同期上升14.21%。
3月份,申报临床试验数量最多的企业(机构)是阿斯利康,申报数量为20项,其次为默沙东,临床试验数量为19项,随后为辉瑞制药,新开设临床试验数量为18项。在开展临床试验 Top10 企业中,增幅最大的是武田制药,新开设的临床试验数量从上个月的5项增加至本月的16项,月增幅3.2倍;增幅超过100%的企业还有艾博维和罗氏制药,月增幅分别为1.75倍及1.17倍。新开临床试验未增加的Top10热门企业仅有诺华制药,增长幅度为0.00%。
对比Top3临床试验申报大企业(阿斯利康、默沙东、辉瑞)在临床适应症和药物类型方面的分布可知,三家主力公司竞争最为激烈的领域为组织分类肿瘤,其次为肺部领域和呼吸道疾病领域。
在组织分类肿瘤领域中,默沙东和辉瑞制药于组织分类肿瘤领域的分布最多,均有5项;其次为阿斯利康(4项)。在默沙东的临床试验中,从试验阶段来看,仅有一项为Ⅲ期临床,三项Ⅱ期临床和一项早Ⅰ期临床。Ⅲ期临床试验的试验药物为Nemtabrutinib,本品是(MK-1026:曾用名ARQ-531)是第二代BTKi,是野生型和C481S突变体布鲁顿酪氨酸激酶(BTK)的可逆的双重抑制剂,该临床试验的适应症为慢性淋巴白血病(NCT05624554)。其余临床试验的主申请人均为默沙东,默沙东均作为第二或第三位申请人申报。在三项Ⅱ期临床试验中,有两项试验的主申请人为大学:其中1项的主申报人为美国埃默里大学,试验疗法为Enfortumab Vedotin与Pembrolizumab 联合疗法在膀胱鳞状细胞癌中的效果(NCT05756569);另一项临床试验的主申请人为美国乔治城大学,试验药物为BXCL701,BXCL701(talabostat)是一种首创的(first-in-class)二肽基肽酶(DPP)口服小分子抑制剂,该试验的适应症为胰腺导管腺癌(BXCL701)。剩下一项临床试验的主要申报单位为澳大利亚新西兰妇科肿瘤小组,主要试验药物为Eribulin Mesylate,甲磺酸艾日布林是一种合成的大田软海绵素类似物,由卫材公司研发,剂型为注射液,用于治疗局部晚期或转移性乳腺癌患者,该试验的适应症为卵巢癌肉瘤(NCT05619913)。 剩余的一项早Ⅰ期临床的主要申请人为Abramson Cancer Center at Penn Medicine,试验疗法为Pembrolizumab 与Lenvatinib联合疗法,适应症分别为肾细胞癌(NCT05733715)。辉瑞在组织分类肿瘤领域的5项临床试验的进度整体更早,仅有两项Ⅱ期临床,一项Ⅰ期临床和两项非标准临床试验。其中两项Ⅱ期临床试验均不作为第一申报人进行申请。其中一项Ⅱ期临床的主申请人为自然人Bradley A. McGregor,试验药物为Axitinib,原研阿昔替尼(axitinib,Inlyta),又叫阿西替尼,是辉瑞开发的一款小分子酪氨酸激酶抑制剂,作用靶点包括VEGFR、Kit、PDGFR,适应症为晚期透明细胞肾细胞癌(NCT05176288)。另一项临床试验的主要申请方为德国的University of Ulm,试验药物为Venetoclax与Rituximab的联合疗法,适应症为华氏巨球蛋白血症(NCT05099471),剩余的一项Ⅰ/Ⅱ期临床的主申请人为辉瑞制药,试验药物为PF-07901801,PF-07901801最初由Trillium Therapeutics 公司开发。这是一种重组融合蛋白,由抗体的Fc区和SIRPα蛋白的工程变体组成,适应症为弥漫性大B细胞淋巴瘤(NCT05626322)。阿斯利康的三项组织分类肿瘤临床试验中,有一项批准后研究(日本,Calquence CLL 1L,NCT05665374);两项Ⅱ期临床(Osimertinib、Ⅱ-Ⅲb期非小细胞肺癌、NCT05526755;Monalizumab、局部晚期头颈部鳞状细胞癌、NCT05414032)。
在肺部疾病领域,阿斯利康布局的临床试验数量最多、有6项,默沙东有4项临床试验,辉瑞制药有2项。其中辉瑞有一项Ⅲ期,两项Ⅱ期,一项Ⅰ期试验和两项非标准临床试验。Ⅲ期试验药物为Tozorakimab,Tozorakimab (MEDI-3506) 是一种靶向白介素-33 (interleukin-33) 的人免疫球蛋白 G1 单克隆抗体,适应症为阻塞性肺疾病COPD(NCT05742802)。在两项Ⅱ期临床试验中,由阿斯利康作为主申请人的试验药物为Osimertinib,适应症为Ⅱ-Ⅲb期非小细胞肺癌(NCT05526755),阿斯利康作为第二申请人的Ⅱ期临床试验药物为Durvalumab,度伐利尤单抗(Durvalumab、Imfinzi、得瓦鲁单抗)是阿斯利康公司研发的一种IgG1κ型单克隆抗体,2017年5月1日获得美国食品和药物管理局FDA批准上市,度伐利尤单抗作为程序性细胞死亡配体(PD-L1)阻断剂,能与肿瘤细胞上的PD-L1结合,并阻断其与T细胞及抗原递呈细胞PD-1的相互作用,从而解除PD-1/PD-L1介导的免疫抑制,促进T细胞攻击肿瘤细胞。该药物的临床适应症为非小细胞肺癌(NCT05617963)。一项Ⅰ期临床试验的试验药物为Nintedanib(NCT05644600)。默沙东在肺部疾病领域方面有四项临床试验,包括一项Ⅲ期,两项Ⅱ期和一项COVID-19疫苗试验。Ⅲ期临床试验的试验药物为Ramucirumab,Ramucirumab 是人 VEGFR-2 拮抗剂,具有抗实体瘤作用。Ramucirumab 是一种人源化单克隆抗体,可与 VEGFR-2 结合,阻止 VEGFR 配体 VEGF-A,VEGF-C 和 VEGF-D 结合,该试验适应症为复发性肺非小细胞癌(NCT05633602)。两项Ⅱ期临床试验中,由默沙东作为第一申报人的临床试验药物为MK-5475,MK-5475(可溶性鸟苷酸环化酶刺激剂)概念试验的临床前证明显示有针对性地降低血管阻力和压力,该试验的适应症为肺动脉高血压(NCT05612035)。另一项Ⅱ期临床试验的第一申报单位为上海胸科医院,试验疗法为Pembrolizumab与Bevacizumab的联合疗法,适应症为非小细胞肺癌(NCT05751187)。辉瑞制药的两项肺部领域临床试验均为非标准分类临床试验,适应症分别为呼吸机相关性肺炎(NCT05671328)和COVID-19(NCT05621239)。
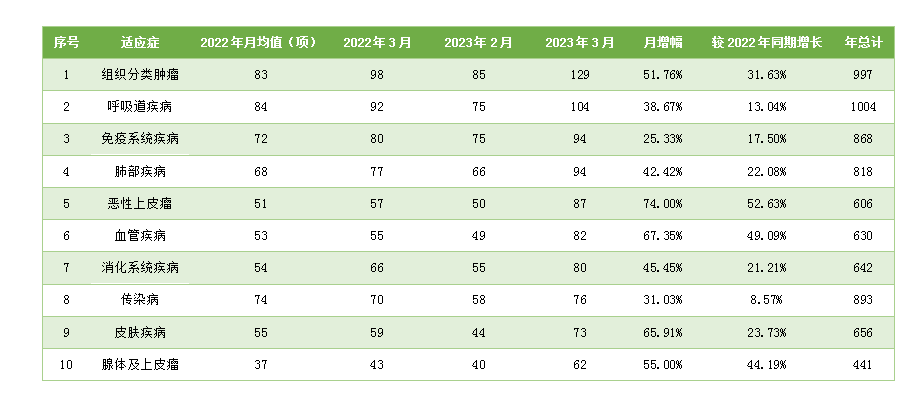
从3月份新增临床试验热门适应症领域来看,组织分类肿瘤仍为最主要的热门研发领域, 试验数量为129项,相较1月份上升51.76%;其次为呼吸道疾病,数量相较于上月上升38.67%。月增幅最高的热门适应症为恶性上皮瘤,单月增幅为74.00%,其次为血管类疾病(67.35%)和皮肤类疾病(65.91%)。本月热门领域临床试验相较于上月及去年同期无下降领域,月增幅最小的热门领域为免疫系统疾病(25.33%),相较于七年同期水平上升幅度最小的领域为传染病(8.57%)。
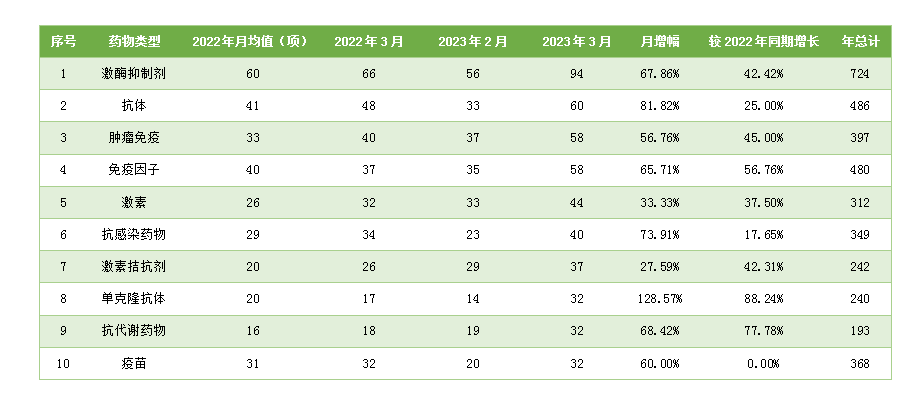
对新增药物类型临床试验进行统计后发现,3月份热门药物类型临床试验数量均呈现上升趋势,增长幅度最大的药物门类为单克隆抗体,较上月上升128.57%;其次为抗体,上升幅度为81.82%。相较于上个月,上升幅度最小的热门药物品类为激素拮抗剂(27.59%)。相较于去年同期水平,仅有疫苗类产品临床试验数量出未出现上涨。
对临床试验的申请国家及地区进行统计后发现,当月美国仍为临床试验开展最为主要的国家,其次是中国。相较于2月份,新增临床试验上升幅度最高的地区为韩国,上涨幅度达到61.11%。唯一发生临床试验数量注册下降的热门地区为中国,月降幅为10.99%,但相较于去年同期,中国临床试验数量仍上涨7.25%。
(数据来源于美国 Clinicaltrial 数据库,标签间存在统计重复,统计时间为2023年4月4日)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
相关阅读
- 2023年4月份Clinicaltrial数据库显示全球新开临床试验数量环比减少15.73%
- 2月份美国Clinicaltrial数据库临床试验数据显示—— 筛选患者成为临床试验开展又一目的
-
为你推荐