2023年6月份中美欧批准上市新药盘点——我国批准16款新药上市
- 2023-07-31 11:04
- 作者:陈倩
- 来源:中国医药报
6月份中美欧批准上市的新药中,中国批准上市新药数量超过美国和欧盟,且有7款为我国自主研发的新药。
中国批准16款新药上市
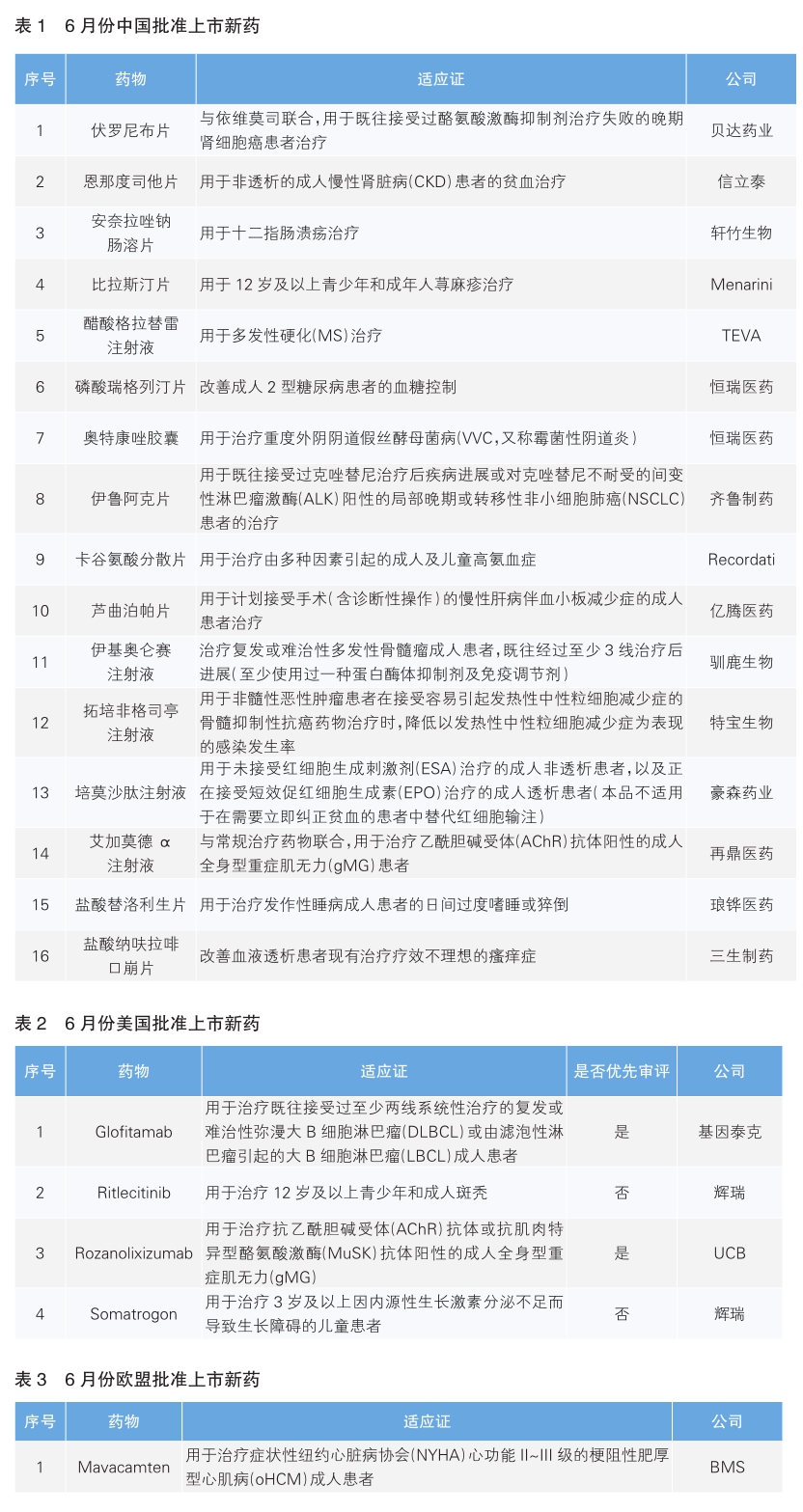
6月份,中国批准16款新药上市(详见表1)。根据Pharmadigger数据库,伏罗尼布片、安奈拉唑肠溶片、磷酸瑞格列汀片、伊鲁阿克片、伊基奥伦塞注射液、拓培非格司亭注射液和培莫沙肽注射液7款药物为我国自主研发并在全球范围内首次获批上市的新药。
伏罗尼布是贝达药业自主研发的针对VEGFR、PDGFR、c-Kit、Flt-3、CSF1R等多靶点的激酶抑制剂。伏罗尼布治疗肾细胞癌患者的Ⅱ/Ⅲ期临床试验(CONCEPT研究)结果显示:伏罗尼布与依维莫司联合治疗组中位无进展生存期(PFS)达10个月,高于依维莫司单药组的6.4个月;伏罗尼布单药组与依维莫司单药组PFS没有差异,中位PFS均为6.4个月。
恩那度司他是一款口服活性低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)。2019年12月,信立泰从Japan Tobacco公司引进该药物。HIF-PHI抑制脯氨酰羟化酶的结构域,可以稳定缺氧诱导因子,通过增加内源性促红细胞生成素生成、改善铁的吸收、下调铁调素水平来促进红细胞的合成,进而治疗贫血。恩那度司他已于2020年9月在日本获批上市。
安奈拉唑是轩竹生物自主研发的质子泵抑制剂(PPI)。一项关于安奈拉唑钠的Ⅱ期临床试验共纳入150例十二指肠溃疡患者,结果显示,安奈拉唑钠治愈率与对照组雷贝拉唑钠相当,能够促进溃疡愈合,并缓解溃疡相关症状。此外,安奈拉唑钠显示了良好的的安全性和耐受性。
比拉斯汀是由西班牙Faes Farma公司研发的一种非镇静性的长效组胺拮抗剂,可选择性地拮抗外周H1受体,对毒覃碱受体无亲和力。单次给药后,比拉斯汀会持续24小时抑制组胺诱导产生皮肤红肿和疱疹反应。目前比拉斯汀已在多个欧洲国家上市。Menarini于2012年获得该产品在亚太地区17个市场的商业化权益。
格拉替雷是Teva制药研发的一种由4种氨基酸 (谷氨酸、赖氨酸、丙氨酸和酪氨酸) 组成的肽段共聚物混合物,被认为是通过改变造成多发性硬化发病机制的免疫过程而起作用。该药物最早于1996年获FDA批准上市。
奥特康唑是恒瑞医药于2019年6月从美国Mycovia公司引进的一种新型、小分子、高选择性CYP51真菌抑制剂。本次获批基于奥特康唑治疗霉菌性阴道炎(VVC)的Ⅲ期临床试验,结果显示奥特康唑治疗重度VVC的疗效显著优于现有标准治疗药物,且整体安全性良好。奥特康唑用于减少复发性外阴阴道假丝酵母菌病(RVVC)患者VVC发作的适应证已于2022年4月在美国获批。
瑞格列汀是恒瑞医药自主研发的一款二肽基肽酶4(DPP-4)抑制剂。这类药物不直接刺激胰岛,而是通过促进肠道内肠促胰素的分泌,实现对胰岛素分泌的灵活控制。恒瑞医药正在开展磷酸瑞格列汀片单药治疗、磷酸瑞格列汀片联合二甲双胍及磷酸瑞格列汀片联合二甲双胍和SGLT2抑制剂恒格列净片的临床试验,用于治疗2型糖尿病。
伊鲁阿克是齐鲁制药自主研发的一款新型ALK/ROS1抑制剂,可抑制不同融合类型的野生型及ALK抑制剂耐药突变的ALK激酶活性;还能有效抑制不同融合类型ROS1激酶活性。本次获批基于一项Ⅱ期单臂临床试验,试验共入组146例ALK阳性非小细胞肺癌(NSCLC)患者,中位随访时间18.2个月,独立评审委员会(IRC)评估的客观缓解率(ORR)为69.9%,疾病控制率(DCR)为96.6%, 中位PFS为19.8个月;在基线有脑转移的90例患者中,IRC评估的ORR为63%。
卡谷氨酸分散片是Recordati公司研发的一款血液疾病治疗药物,其有效成分卡谷氨酸是一种合成的N-乙酰谷氨酸(NAG)结构类似物,由N-乙酰谷氨酸合成酶(NAGS)催化合成,是肝脏线粒体中必不可少的氨甲酰磷酸合成酶-1(CPS-1)的重要变构激活剂。该药通过激活CPS-1改善或恢复尿素循环的功能,并促进氨解毒和尿素生成。
芦曲泊帕是一种口服的、小分子人血小板生成素受体激动剂(TPO-R),由亿腾医药引进。芦曲泊帕通过作用于人血小板生成素(TPO)受体的跨膜区,与内源性TPO相同的方式激活信号转导途径,促进血小板的生成。本次获批基于芦曲泊帕在用于拟接受择期侵袭性手术的慢性肝病血小板减少症患者术前升血小板的治疗研究,结果显示,芦曲泊帕在主要终点第8天的有效应答者比例显著高于安慰剂组。
伊基奥仑赛是由信达生物/驯鹿生物联合开发的国内首款获批的靶向BCMA的自体嵌合抗原受体T细胞免疫治疗产品,该产品于2021年2月获得“突破性治疗品种”认定。伊基奥仑赛本次获批是基于一项Ⅰ/Ⅱ期临床试验,结果显示,在纳入的79例受试者中,ORR为94.9%,其中89.9%的受试者达到非常好的部分缓解(≥VGPR),完全缓解率/严格意义完全缓解率((CR/sCR)达68.4%。
拓培非格司亭是特宝生物自主研发的Y型聚乙二醇(PEG)修饰的人粒细胞刺激因子(rhG-CSF),通过刺激骨髓造血干细胞向粒细胞分化,促进粒细胞增殖、成熟和释放,恢复外周血中性粒细胞数量,以降低肿瘤患者化、放疗后的感染发生率。与目前已上市的同类长效产品相比,拓培非格司亭具有较长的药物半衰期、较低的药物剂量,使用剂量约为目前已上市同类长效产品的三分之一。
培莫沙肽是豪森药业自主研发的首个国产长效促红细胞生成素(EPO)药物。培莫沙肽经聚乙二醇修饰,显著延长半衰期,只需每4周给药一次,明显降低了给药频率,有助提高患者的依从性。培莫沙肽此次获批主要是基于非劣效性关键Ⅲ期临床试验。该试验共纳入372例慢性肾脏疾病患者,结果显示,在慢性肾脏疾病人群中,使用培莫沙肽的患者相较于使用重组人促红细胞生成素(利血宝)的患者,未增加心血管事件风险,依从性良好。
艾加莫德α是一款由Argenx公司研发的人IgG1抗体的Fc片段,可与新生儿Fc受体(FcRn)结合,旨在减少致病性免疫球蛋白G(IgG)抗体并阻断IgG循环,是首个用于全身型重症肌无力患者(gMG)治疗的FcRn拮抗剂。再鼎医药与Argenx达成独家授权合作,在大中华区开发和商业化艾加莫德α。艾加莫德α的全球性Ⅲ期临床试验ADAPT的结果显示,与安慰剂组相比,在接受艾加莫德α治疗后,AChR抗体阳性的gMG患者对重症肌无力日常活动评分(MG-ADL)评估产生的应答显著增加(68%对比30%)。
替洛利生(Pitolisant)由法国Bioprojet公司研发,分别于2016年3月和2019年8月在欧盟和美国获批上市,是首款选择性组胺3(H3)受体拮抗剂/反向激动剂。该药通过一种全新的作用机制发挥作用,即通过增强组胺能神经元活性,增加大脑中促进觉醒的神经递质组胺的合成和释放,进而提高患者的清醒度和警觉性。琅铧医药于2020年10月与Bioprojet达成合作,获得该药在中国市场的商业化权益。
盐酸纳呋拉啡是由东丽株式会社研发的选择性阿片κ受体激动剂,通过与现有的抗组胺药或抗过敏药完全不同的新作用机制发挥止痒作用。2009年,盐酸纳呋拉啡软胶囊剂在日本获批上市,用于改善血液透析患者的瘙痒症,该药的口腔崩解片剂型也于2017年在日本获批上市。2017年12月,东丽授予三生制药在中国开发及商业化盐酸纳呋拉啡口腔崩解片的独家权利。该药本次获批是基于一项在中国完成的桥接临床试验结果,结果显示,盐酸纳呋拉啡5μg和2.5μg组均桥接成功,与日本验证性试验结论一致。
美国批准4款新药上市
6月份,美国批准上市4款新药(详见表2)。根据Pharmadigger数据库,其中除Somatrogon外,其他新药均为全球首次批准。
Glofitamab(商品名:Columvi)是罗氏子公司基因泰克研发的一款具有2∶1结构(2个CD20结合域和1个CD3结合域)的IgG1样全人源化双特异性抗体,可靶向T细胞表面的CD3和B细胞表面的CD20。FDA此次批准主要是基于代号为NP30179的Ⅰ/Ⅱ期临床试验,结果显示,Glofitamab联用奥妥珠单抗治疗弥漫性大B细胞淋巴瘤(DLBCL)患者,有43.0%(57/132)的患者实现完全缓解,约一半的患者实现客观缓解,中位缓解持续时间为1.5年。
Ritlecitinib(商品名:Litfulo)是辉瑞公司研发的一种JAK3/TEC共价抑制剂。斑秃是一种自身免疫性疾病,具有潜在的免疫炎症发病机制,在免疫系统攻击身体的毛囊时导致头发脱落,Ritlecitinib通过阻断细胞因子的信号传导和T细胞活性发挥作用。一项名为ALLEGRO Ⅱb/Ⅲ期临床试验评估了Ritlecitinib治疗12岁及以上斑秃患者(n=718)的疗效。结果显示,接受Ritlecitinib的30mg剂量和50mg剂量治疗的患者,在治疗6个月后头皮毛发覆盖率达到80%或更多(即斑片状斑秃及脱发严重度评分SALT≤20)的患者比例显著高于安慰剂组。
Rozanolixizumab(商品名:Rystiggo)是UCB公司开发的一种皮下注射的人源化单克隆抗体,以高亲和力特异性结合人类新生儿 Fc 受体 (FcRn);通过阻断FcRn 和免疫球蛋白 G (IgG) 的相互作用,加速抗体的分解代谢并降低致病性 IgG 自身抗体的浓度。本次批准基于名为MycarinG的Ⅲ期临床试验,结果显示,在300例gMG患者中,治疗后第43天,接受Rozanolixizumab治疗的患者包括MG-ADL评分在内的疾病严重程度指标有统计学意义上的显着改善。
Somatrogon(商品名:Ngenla)是辉瑞公司研发的一种长效人类生长激素(hGH)分子,通过皮下注射,旨在补充人体内生长激素的缺乏来发挥作用。FDA批准是基于一项Ⅲ期临床试验结果。该试验评估了224例未经治疗的生长激素缺乏症青春期前儿童患者每周注射1次Somatrogon与每天注射生长激素Genotropin的有效性和安全性。结果显示,在第12个月主要终点年化高度速度方面,Somatrogon与Genotropin相比达到非劣效性标准。
欧盟批准1款新药上市
6月份,欧盟批准了1款新药上市(详见表3),根据Pharmadigger数据库,该款新药最早于2022年4月在美国获批上市。
Mavacamten是百时美施贵宝公司通过收购MyoKardia公司获得的一种针对梗阻性肥厚型心肌病(oHCM)的心肌肌球蛋白ATP酶选择性变构抑制剂。Mavacamten具有独特的作用机制,可通过减少肌动蛋白-肌球蛋白交叉桥的形成,改善心肌能量代谢,降低压力梯度,缓解梗阻程度,从而改善oHCM患者的症状和生活质量。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐