每周医药看点(8月11日—17日)
- 2025-08-21 11:43
- 作者:刘鹤
- 来源:中国医药报
国家医保局对2025年国家医保药品目录初步形式审查结果进行公示,534个药品通过形式审查;国家药监局药品审评中心(CDE)发布《骨关节炎新药临床研发技术指导原则》,鼓励骨关节炎创新药物研发……8月11日—17日,医药行业的这些动态值得关注。
行业政策及药监动态
1.国家医保局发布《关于公示通过2025年国家基本医疗保险、生育保险和工伤保险药品目录及商保创新药目录调整初步形式审查的药品及相关信息的公告》。公告显示,2025年共有534个药品通过基本医保目录初步形式审查,121个药品通过商保创新药目录初步形式审查。
2.CDE发布《骨关节炎新药临床研发技术指导原则》,鼓励针对骨关节炎这一疾病潜在病理生理和结构进展的创新药物开发。指导原则仅适用于按化学药品和治疗用生物制品研发的治疗药物,不包括细胞治疗和基因治疗产品。
3.CDE就《罕见病用化学药物药学研究指导原则(征求意见稿)》公开征求意见。制定该指导原则,旨在提高罕见病药物研发效率,鼓励和加速推动罕见病药物研发上市。
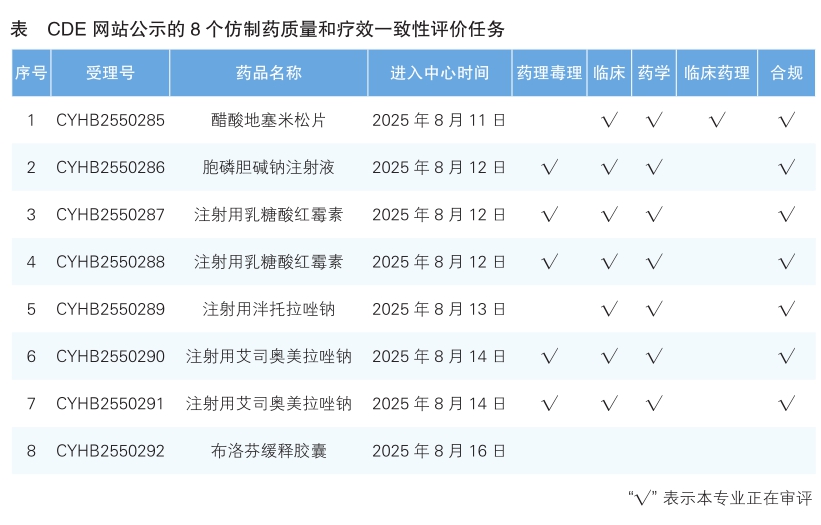
4.CDE网站公示8个仿制药质量和疗效一致性评价任务(详见表),涉及醋酸地塞米松片等品种。
产品研发上市信息
1.国家药监局发布5期药品批准证明文件送达信息,共包括121个受理号,涉及湖南洞庭药业股份有限公司等企业。
2.CDE承办受理56个新药上市申请,包括司美格鲁肽注射液等。
3.亚盛医药宣布,公司自主研发的Bcl-2选择性抑制剂利沙托克拉联合阿扎胞苷治疗新诊断的中高危骨髓增生异常综合征患者的全球注册Ⅲ期临床试验获美国食品药品管理局(FDA)和欧洲药品管理局(EMA)批准。
4.启函生物宣布,公司研发的通用型双靶点CAR-T细胞疗法(QT-019B)的新药临床试验申请已获得美国FDA批准,计划在美国开展QT-019B治疗难治性系统性红斑狼疮的临床试验。
5.纽伦捷生物宣布,公司研发的基于原位转分化技术的创新药NRG-103注射液的新药临床试验申请已获得美国FDA批准,可正式开展针对胶质母细胞瘤的临床研究。
医药企业观察
1.北海康成宣布与百洋医药达成股份认购协议,百洋医药将以每股1.34港元的价格认购北海康成价值约1亿港元的股份。同时,北海康成与百洋医药签署一项独家商业服务协议。根据该协议,百洋医药旗下子公司将获得北海康成旗下特定产品在许可区域的推广权。
2.复星医药宣布,其控股子公司上海复星医药产业发展有限公司与美国生物技术公司Expedition Therapeutics,Inc.签订许可协议,授予Expedition小分子口服二肽基肽酶1抑制剂XH-S004在许可区域的开发、生产及商业化权利。根据协议,Expedition将向复星医药支付最高1.2亿美元的不可退还首付款、开发及监管里程碑付款;未来还将基于XH-S004在许可区域的年度净销售额的达成情况,支付最高5.25亿美元的销售里程碑款项。
3.京东健康宣布,与知原药业签署战略合作协议。双方将聚焦皮肤健康领域,在医药供应链、全域营销、跨境药品等方面展开合作。知原药业将其仿制药吡美莫司软膏的独家核心包销权授予京东健康,并持续加码京东生态平台的站内外全链路资源投入。
4.步长制药发布公告称,公司控股子公司山东丹红制药有限公司拟与山东中医药大学附属医院签署《技术转让(开发)合同》,以1500万元人民币的价格受让山东中医药大学附属医院拥有的中药二至调经优化方技术所有权,用于新药开发。
药品集中采购
1.广东省药品交易中心发布《广东联盟常见病慢性病药品接续采购文件》(以下简称《文件》),开展广东联盟常见病慢性病药品接续采购工作。根据《文件》,提供药品及伴随服务的国内药品生产企业、国内药品上市许可持有人、境外药品上市许可持有人境内代理人,在质量标准、生产能力、供应稳定性、企业信用等方面达到本次接续集采要求的均可参加。本次接续集采品种范围包括阿米卡星等品种;采购周期原则上为两年,自中选结果实际执行日起计算,首年采购期截至2026年12月31日。
2.山西省医保局发布《山西省医疗保障信息平台药品挂网规则(试行)》,自2025年10月1日起施行。在价格联动方面,要求新增挂网药品需提供申报产品全国挂网价格最低的六个省级平台挂网价。申报挂网价格不得高于全国省级平台最低挂网价。如新增挂网产品为国家组织集采药品未中选的同通用名同剂型原研药品、参比制剂、通过一致性评价药品,申报挂网价格不得高于“上海市梯度降价”结果。
3.上海市医药集中招标采购事务管理所发布《关于开展全国中成药采购联盟集中采购(ZCYLM-2024-2)中选品种申报挂网工作的通知》,上海将对全国中成药集采首批扩围接续药品进行挂网,申报挂网时间为2025年8月12日至8月29日。(刘鹤整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐