每周医药看点(8.23—8.29)
- 2023-08-31 15:38
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 《第四批鼓励研发申报儿童药品清单》发布;国家药监局发布第七十二批仿制药参比制剂目录;对乙酰氨基酚口腔崩解片由处方药转换为非处方药……8月23日—8月29日,医药行业的这些动态值得关注。
行业政策动态
1.国家卫生健康委会同科技部、工业和信息化部、国家药监局制定的《第四批鼓励研发申报儿童药品清单》出炉,共入选24个品种,涉及30个品规、9种剂型,覆盖神经系统用药、消化道和新陈代谢用药、抗肿瘤药及免疫调节剂等治疗领域。
2.国家药监局发布公告,决定适用《Q12:药品生命周期管理的技术和监管考虑》国际人用药品注册技术协调会指导原则(以下简称Q12)。Q12为药品上市后变更管理提供了新的实现方法和监管工具,申请人可以按照目前我国变更管理的相关法规规章和指导原则进行变更管理,也可以在提交上市申请和/或补充申请时采用Q12提供的新方法进行变更管理。申请人在实施Q12前,应充分评估是否具备适用该指导原则的研发基础和实施条件。
3.国家药监局发布仿制药参比制剂目录(第七十二批),涉及贝前列素钠缓释片等药品。
4.国家药监局发布公告,决定对榄香烯注射剂(包括榄香烯乳状注射液、榄香烯注射液)、琥珀酰明胶注射液、洛芬待因制剂(包括洛芬待因片、洛芬待因缓释片)说明书内容进行统一修订。
5.国家药监局发布公告,对乙酰氨基酚口腔崩解片由处方药转换为非处方药。品种名单及其非处方药说明书范本一并发布。
6.国家药监局综合司就《药品附条件批准上市申请审评审批工作程序(试行)(修订稿征求意见稿)》公开征求意见。相比现行版本,修订稿征求意见稿细化工作程序具体要求,完善快速通道与常规通道的转换机制,明确提出附条件批准上市的品种/适应证在完成所附条件研究并转为常规批准后方可开展再注册工作。修订稿征求意见稿将药品附条件批准上市的工作程序分为早期沟通交流申请(Ⅱ类会议)、上市申请前的沟通交流申请(Ⅱ类会议)、提交附条件批准上市申请、附条件批准上市申请审评审批、所附条件的研究、常规批准等环节,并细化要求。
7.国家药监局综合司就《国家药监局锝标记及正电子类放射性药品检验机构评定程序(征求意见稿)》公开征求意见,鼓励有能力和条件的药品检验机构开展锝标记药物及正电子类放射性药品检验能力的建设,增加有资质的检验机构。
8.国家药监局综合司就《地区性民间习用药材管理办法(修订草案征求意见稿)》公开征求意见。修订草案征求意见稿充分体现“地区性”“民间”“习用”的特点,将尚不具有法定标准(包括国家药品标准和省级药品标准)的自种自采自用的中草药纳入地区性民间习用药材的范围。此外,对于原办法规定“地区性民间习用药材”的定义范围限定为“国家药品标准未收载,且不具有药品注册标准,但被本草、医籍、方志等记载,在局部地区有多年药用习惯”,考虑当前法规对其管理主要在乡村医疗机构使用环节,修订草案征求意见稿和原有法规进行了链接,仅作原则性表述。
9.国家药监局药品审评中心再次公开征求《临床试验期间生物制品药学变更和研究技术指导原则(征求意见稿)》和《已上市疫苗药学变更研究技术指导原则(征求意见稿)》意见,征求意见截止日期为2023年9月27日。
10.国家药监局药品审评中心网站公示14个仿制药一致性评价任务,涉及注射用头孢他啶等品种。(截至8月29日)
产品研发上市信息
1.国家药品监督管理局附条件批准迪哲(江苏)医药股份有限公司申报的1类创新药舒沃替尼片(商品名:舒沃哲)上市。该药适用于既往经含铂化疗治疗时或治疗后出现疾病进展,或不耐受含铂化疗,并且经检测确认存在表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者。
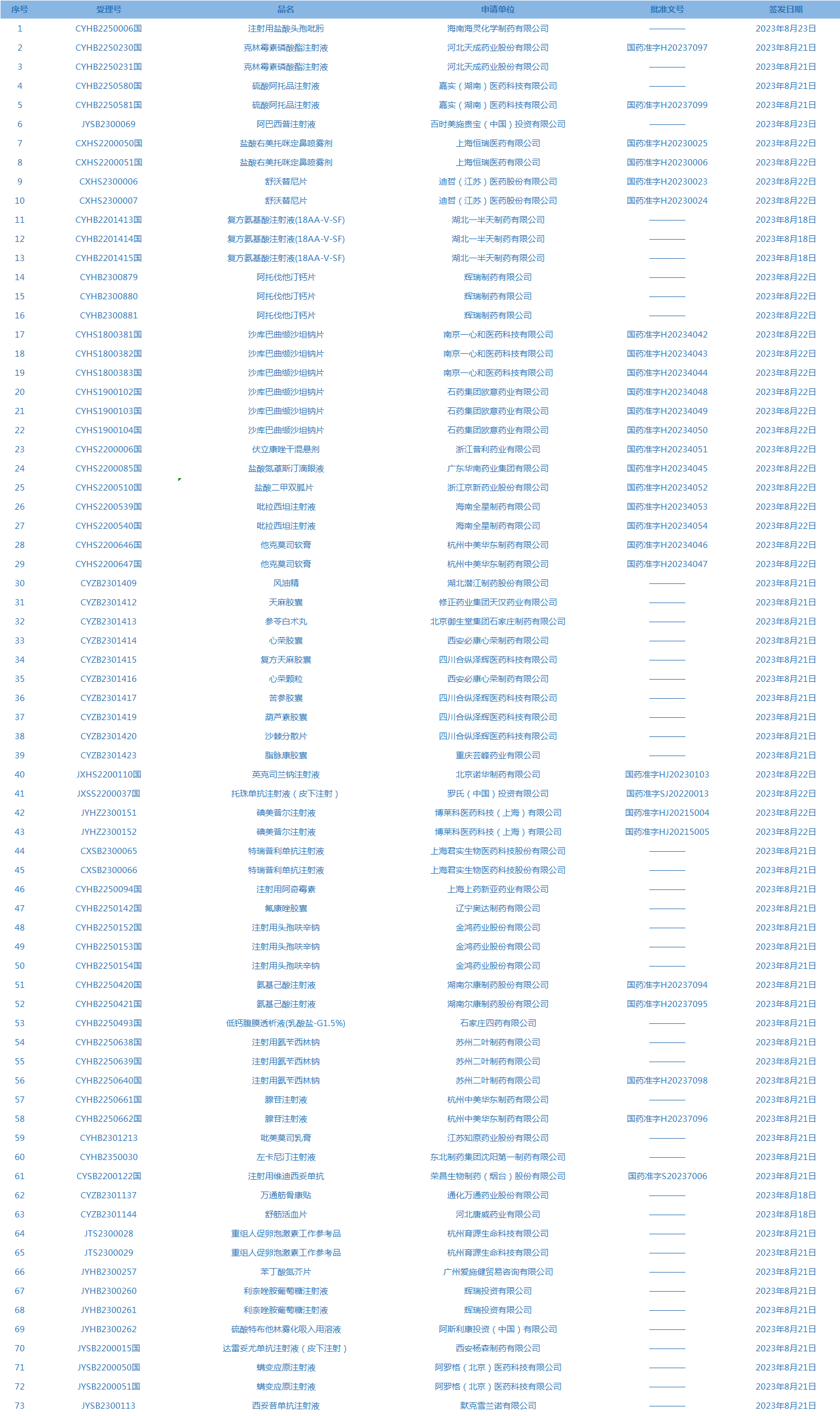
2.国家药监局发布3期药品批准证明文件送达信息,共包括73个受理号,涉及海南海灵化学制药有限公司等企业。(截至8月29日)
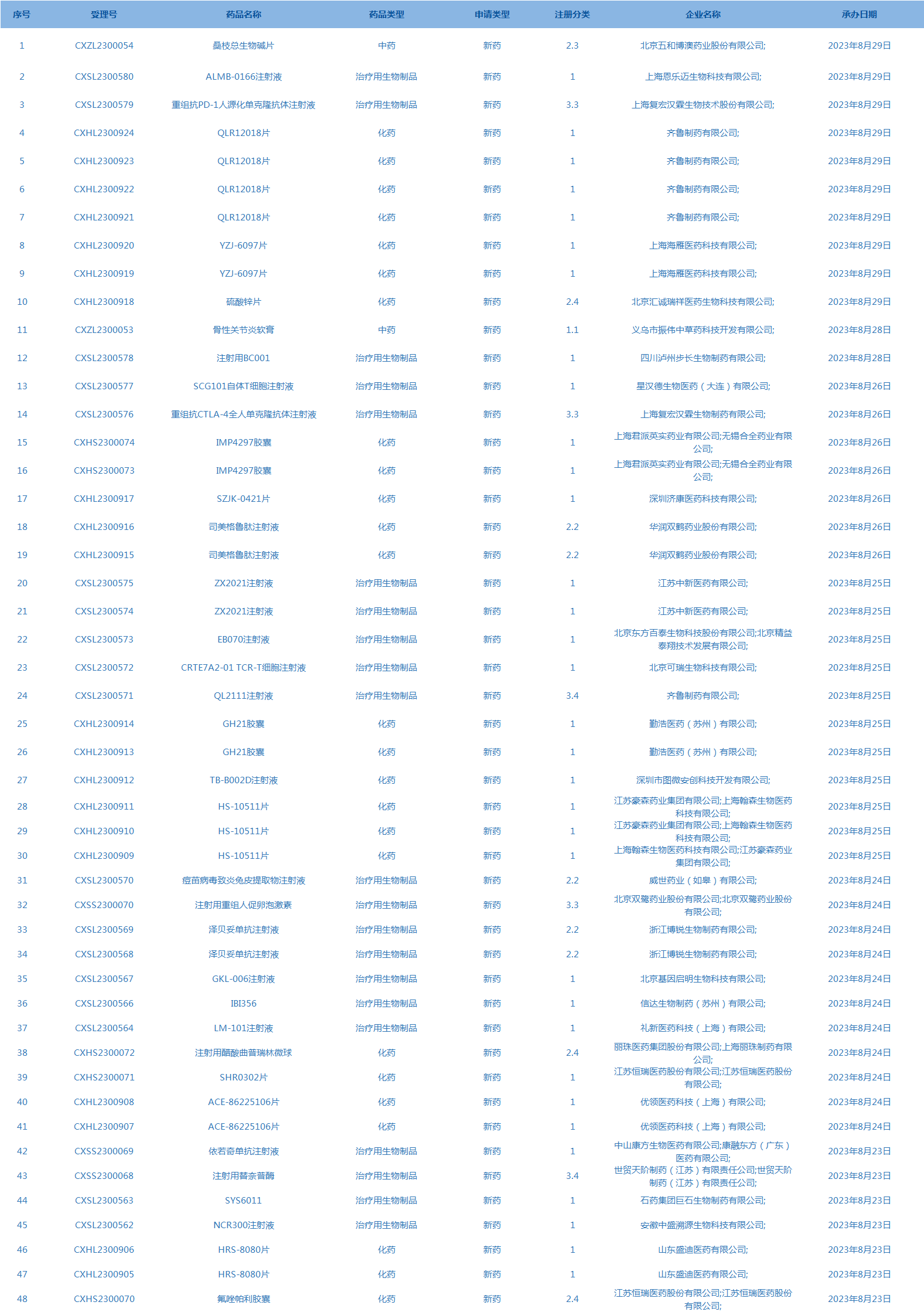
3.CDE承办受理48个新药上市申请,包括ALMB-0166注射液等药品。(截至8月29日)
4.本导基因宣布,其BD112体内基因编辑疗法获得欧盟委员会(EC)授予的孤儿药资格,拟用于治疗亨廷顿舞蹈症。
5.和铂医药宣布,公司已获美国食品药品管理局(FDA)的新药研究申请许可(IND),将在美国启动抗体偶联药物(ADC)HBM9033的临床试验。
6.浩博医药宣布,公司反义寡核苷酸(ASO)药物AHB-137针对慢性乙肝患者的临床试验已获得美国FDA批准。
7.华津医药宣布,其自主研发的溶瘤细菌桑美威克用于治疗小细胞肺癌(SCLC)的适应证获得美国FDA授予的孤儿药资格认定。
医药企业观察
1.劲方医药与Verastem Oncology宣布达成独家授权及早期合作开发协议。Verastem公司将作为独家合作伙伴,获得三款由劲方医药开发、以RAS通路靶向药领衔的创新疗法在大中华区之外的全球开发和商业化权利。根据协议,Verastem公司将就首个合作项目向劲方医药支付1150万美元预付款,包括首付款及研发支持、选择权费用。劲方医药完成协议框架内每款产品的特定里程碑后,Verastem公司皆有权行使相关产品的独家商业化引进权。劲方医药可获得总额超过6.25亿美元的潜在后续里程碑付款,在Verastem公司行权引进的产品上市后,劲方医药还将依据销售净额获得特许权使用费。
2.阿尔法分子科技宣布完成A轮融资,本轮融资由上海生物医药基金领投,华仟资本跟投,原股东新恒利达资本继续注资。阿尔法分子科技成立于2020年,专注于利用生物计算、人工智能和原创生物技术进行创新药物研发。
3.艾凯生物宣布完成亿元A++轮融资,本轮融资由原股东知一投资领投,西湖科创投跟投。募集资金主要用于“清除了表观遗传记忆”的超能iPSC(诱导多能干细胞)的持续产业化工作,以及肿瘤、帕金森病等领域产品管线的临床推进。
药品集中采购
1.国家集采联合采购办公室发布《关于开展第九批国家组织药品集中采购相关药品信息填报工作的通知》,填报范围共包括44个品种、195个品规。
2.河北省医用药品器械集中采购中心公示河北牵头京津冀化学药品、生物制剂集中带量采购拟中选结果,此次集采共有98个品种、147个品规拟中选,涉及102家药企。
3.安徽省医保局就《安徽省省级药品集中采购接续工作方案(征求意见稿)》公开征求意见。征求意见稿指出,安徽省集采中选,与国家组织集采同厂家、同品规的药品,调出省采模块,调整为“国家集采药品”属性,执行“国家集采中选价”。安徽省集采中选、与国家集采中选不同品规的未通过一致性评价的药品,过评生产企业超过3家,禁用非过评品;过评生产企业少于3家,企业自主降价,价格须低于国家药品集中采购(安徽)同品种中选价,保留省集采中选身份。
(刘思慧整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐