每周医药看点(10.18—10.24)
- 2023-10-26 15:36
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国家药监局发布《关于加强药品上市许可持有人委托生产监督管理工作的公告》 ;狂犬病人免疫球蛋白说明书修订……10月18日—10月24日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局发布《关于加强药品上市许可持有人委托生产监督管理工作的公告》,就药品上市许可持有人委托生产的许可管理、质量管理和监督检查等提出明确要求。《公告》严格委托生产的许可管理,提出申请材料、申请时间、许可检查、许可证标注等要求。《公告》表示,申请人拟委托生产药品、申请办理药品生产许可证(以下称B类许可证)或者申请B类许可证许可事项变更的,省级药品监管部门应当严格审核受托生产企业所在地省级药品监管部门出具的药品GMP符合性检查告知书、同意受托生产的意见。各省级药品监管部门应当指导申请人在完成相应研究、验证,并做好接受药品注册核查检验等准备工作后,再提出药品生产许可证的核发申请或者增加生产范围的申请。根据药品上市注册需要,新核发的药品生产许可证或者药品生产许可证新增生产范围、相应生产范围暂无产品取得上市许可的,应当在药品生产许可证相应生产范围后标注“(仅限注册申报使用)”。《公告》自发布之日起执行。
2.国家药监局发布公告,决定对狂犬病人免疫球蛋白说明书【不良反应】【注意事项】项进行统一修订。
3.国家药监局综合司发布《关于印发药品上市许可持有人委托生产现场检查指南的通知》,《通知》要求各省级药品监管部门对药品上市许可持有人的药品生产全过程、全生命周期质量管理情况加强监督检查,特别是对委托生产药品的情况加强监督检查。检查发现药品上市许可持有人、药品生产企业违反《药品管理法》《药品生产监督管理办法》《药品生产质量管理规范》《药品上市许可持有人落实药品质量安全主体责任监督管理规定》《国家药监局关于加强药品上市许可持有人委托生产监督管理工作的公告》等有关规定的,依法依规调查处理。
4.国家药监局综合司就《药品现代物流规范化建设的指导意见(征求意见稿)》公开征求意见。《指导意见》适用于新开办药品批发企业和接受委托储存运输药品的第三方药品现代物流企业,提出企业应当建立与其储存运输的药品品种和规模相适应的信息化追溯管理体系,配合上市许可持有人落实药品追溯主体责任,按照国家药品监管部门制定的统一药品追溯标准和规范,建立并实施药品追溯制度,采用信息化手段如实记录经营和物流活动,确保全过程数据真实、准确、完整、实时、可追溯。
5.国家药监局综合司就《药品监督管理行政处罚裁量适用规则(征求意见稿)》公开征求意见。该征求意见稿提出,行使行政处罚裁量权,应当依据违法事实、性质、情节、社会危害程度等因素,并综合考虑当事人的主观过错程度、涉案产品的风险性、违法行为造成的损害后果以及社会影响、当事人对违法行为所采取的补救措施及效果等情形;对当事人实施的违法行为,按照违法行为的事实、性质、情节、产品的风险性以及社会危害程度,分别给予从重处罚、一般处罚、从轻或者减轻处罚、不予处罚。
6.国家药监局药品审评中心(CDE)发布《基于人用经验的中药复方制剂新药药学研究技术指导原则(试行)》。该原则明确,以人用经验作为注册审评证据的中药复方制剂新药,应当明确所用药物的药学关键信息;药学关键信息及制剂质量应当与人用经验所用药物基本一致;人用经验药学关键信息应当可追溯。
7.CDE发布《脂质体药物质量控制研究技术指导原则》《脂质体药物非临床药代动力学研究技术指导原则》,以规范和指导脂质体药物研究与评价。
8.CDE就《小儿便秘中药新药临床研发技术指导原则(征求意见稿)》公开征求意见。该征求意见稿系统阐述了小儿便秘的中医药理论特点,提出了人用经验收集整理需重点关注的内容,明确了中药新药可能的临床定位,强调了中医药理论和人用经验对小儿便秘中药新药研发的支持作用,并对临床研发总体考虑、临床试验设计和评价需关注的问题等提出了相关建议;鼓励研究者在临床实践中规范收集和整理人用经验,基于儿童年龄段特点和未被满足的临床需求,借鉴以患者为中心的药物研发理念,开发适宜的疗效评价工具。
9.CDE网站公示23个仿制药一致性评价任务,涉及氯化钾注射液等品种。(截至10月24日)
产品研发上市信息
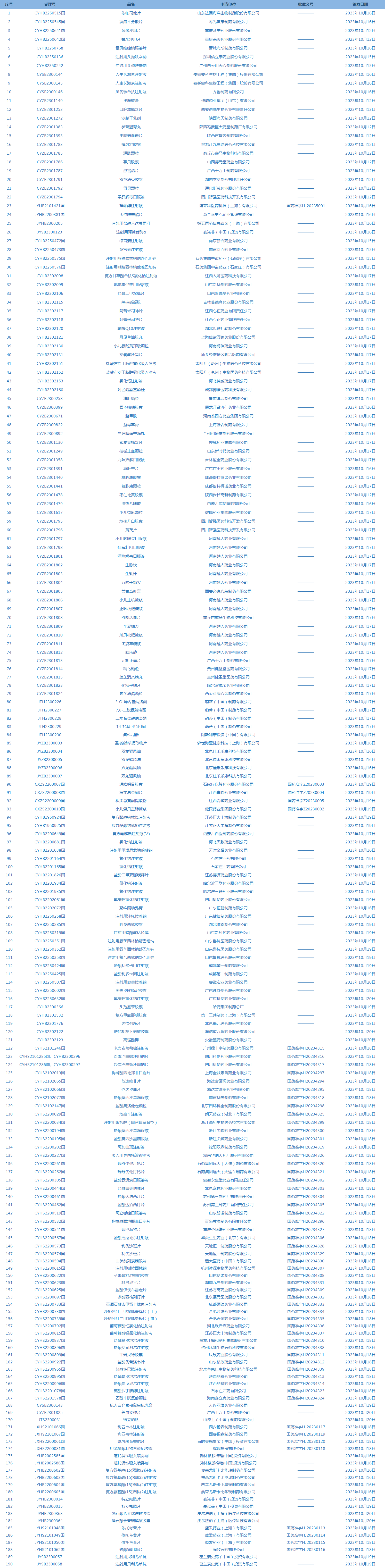
1.国家药监局发布3期药品批准证明文件送达信息,共包括190个受理号,涉及葛兰素史克(中国)投资有限公司等企业。(截至10月24日)
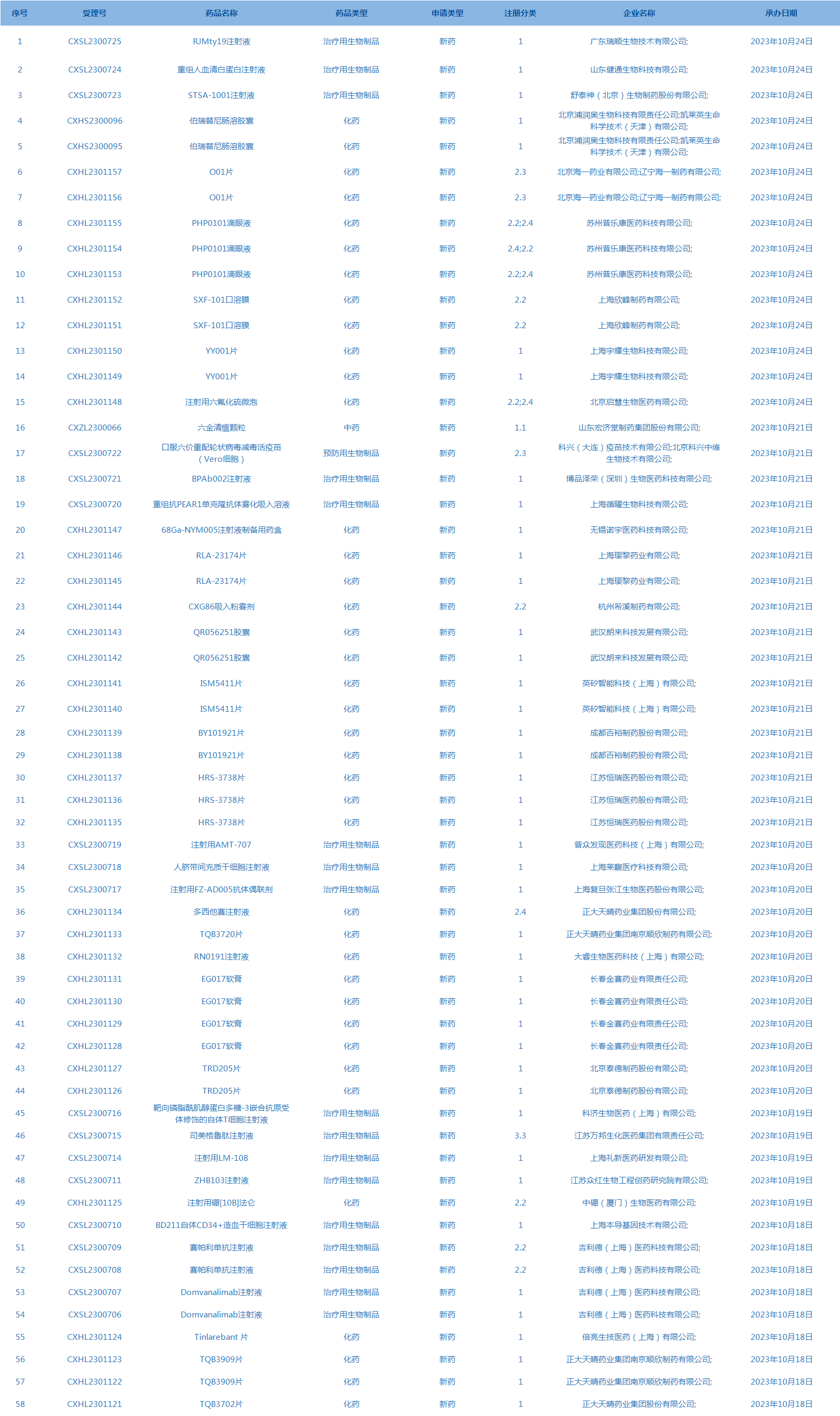
2.CDE承办受理58个新药上市申请,包括重组人血清白蛋白注射液等药品。(截至10月24日)
3.常山药业发布公告称,公司药品依诺肝素钠注射液获得黎巴嫩药品监督管理部门签发的药品注册证书。
4.华海药业发布公告称,其下属子公司华奥泰生物在研抗IL-36R单抗HB0034注射液获得美国食品药品管理局(FDA)授予孤儿药资格,用于治疗泛发性脓疱型银屑病(GPP)。
5.烨辉医药宣布,美国FDA已授予公司产品BN104快速通道资格,用于治疗复发/难治急性白血病。
6.挚盟医药宣布,其自主研发的针对中枢神经系统(CNS)的创新药CB03获得了美国FDA孤儿药资格,用于肌萎缩侧索硬化(ALS)患者的治疗。
医药企业观察
1.礼邦医药宣布与罗氏签订商业化协议。礼邦医药将在中国大陆地区独家推广甲氧聚乙二醇重组人促红素注射液,这是一款仅需每月给药一次的长效促红细胞生成素(ESA),用于治疗慢性肾脏病相关贫血。
2.康龙化成发布公告称,拟以自有资金1050万美元通过全资子公司Pharmaron (Hong Kong) InternationalLimited(以下简称康龙香港国际)与合作方CMS MEDICAL VENTURE PTE.LTD.(以下简称康哲药业)、Rxilient Health Pte. Ltd.(以下简称康联达)、HEALTHY GOAL LIMITED(以下简称君联基金)共同投资位于新加坡的Rxilient Biohub Pte. Ltd.(以下简称合资公司)。投资完成后,康龙化成持有合资公司35%的股权,康哲药业持有合资公司33.8%的股权,康联达持有合资公司11.2%的股权,君联基金持有合资公司20%的股权,合资公司成为康龙化成的参股公司。
3.仙琚制药发布公告称,将通过在产权交易所公开挂牌方式,以不低于标的评估值所对应的价值,公开挂牌转让闲置药品阿昔洛韦片和维生素D3注射液的批准文号及相关生产技术。
4.千金药业宣布拟以自有资金人民币5000万元对湖南新合新生物医药有限公司(以下简称新合新)进行投资。新合新预计通过本轮股权融资项目共融资5亿元人民币。本轮股权融资完成后,新合新的注册资本将由4804万元增加至不超过5711万元,如本轮融资满额募集,千金药业将持有新合新1.587%的股权。
5.诺未生物宣布完成5000万元pre-B轮融资,本轮融资由新投金石和聚焦基金共同投资。本轮融资资金将用于加速推进该公司基于STARi平台开发的抗肿瘤核酸新药的临床研究、扩充专业团队及抗肿瘤新药管线的开发。
药品集中采购
1.国家组织药品联合采购办公室发布《关于第九批全国药品集中采购文件的补充公告》。《公告》指出,为做好与仿制药质量和疗效一致性评价审批工作的衔接,对于2023年10月30日(含)前获得国内有效注册批件的药品,属于本次“采购文件-附表1-品种名称”,但未被列入“附表1-规格”的,相关企业可于11月2日17时前向联合采购办公室提出参加本次集采的申请,并提供药品批件、药品说明书等相关证明材料,经审核通过后,允许参与本次集采申报。相应规格的最高有效申报价按现有差比价规则计算,首年约定采购量基数按“0”计算。
2.湖南省医保局发布《关于做好十四省(区、兵团)药品联盟集中带量采购品种数据填报工作的通知》。《通知》要求,医药机构本次数据填报采取线上直报方式进行,通过“十四省(区、兵团)药品采购联盟报量平台”(网址:http://pub.smpaa.cn/sxblxt)进行数据填报。本次联盟采购按照企业品牌和规格报量,由医药机构按照企业产品填报2022年历史采购量和未来一个年度的采购需求量,原则上不低于2022年历史采购量的80%;未达到的,在系统中说明理由;完成报量后,需上传加盖公章的承诺函。
(刘思慧整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐