2023年9月份中美欧批准上市新药盘点
- 2023-11-08 19:50
- 作者:陈倩
- 来源:中国医药报
2023年9月份中美欧批准上市的新药中,合计有5款为全球首次获批的新药。其中,在我国上市的纳鲁索拜单抗,为我国自主研发、全球范围内首个获批的IgG4亚型全人源抗RANKL(核因子-κB受体活化因子配体)单克隆抗体;在欧盟获批上市的替雷利珠单抗,是我国首个在欧美市场获批的原研PD-1抗体药物。
中国上市4款新药
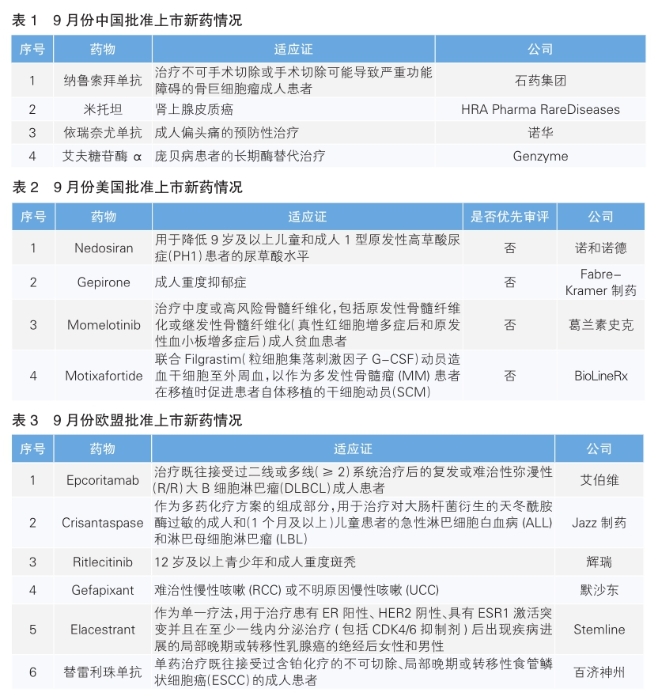
9月份,我国批准了4款新药上市。根据Pharmadigger数据库,纳鲁索拜单抗为我国自主研发且在全球范围内首次获批上市的新药(详见表1)。
纳鲁索拜单抗是石药集团子公司津曼特生物研发的一款重组全人源抗RANKL单克隆抗体。该药采用皮下注射方式,可通过阻断RANKL与破骨细胞前体细胞、破骨细胞、破骨细胞样巨细胞等细胞的膜上受体RANK结合,进而抑制RANKL-RANK信号通路介导的上述细胞分化成熟与功能活性。该药本次获批上市主要是基于两项关键临床试验,结果显示,纳鲁索拜单抗治疗不可切除或手术困难的骨巨细胞瘤具有较好的疗效,同时也表现出了良好的安全性和可控的安全性风险。在纳鲁索拜单抗上市前,地舒单抗是全球唯一一款RANKL抑制剂(IgG2亚型),纳鲁索拜单抗是首个IgG4亚型全人源抗RANKL单抗。
米托坦是HRA Pharma Rare Diseases公司开发的一种肾上腺细胞毒性活性物质,可抑制肾上腺皮质产生皮质类固醇激素。对米托坦作用方式的研究发现,该药有两个主要的生物学效应:一是通过线粒体改变和抑制甾醇-O-酰基转移酶1的活性,对肾上腺皮质细胞产生直接的细胞毒性作用;二是通过改变皮质醇的外周代谢并直接抑制肾上腺皮质分泌皮质类固醇,来抑制皮质类固醇的合成。
依瑞奈尤单抗是诺华研发的首个靶向作用于CGRP受体的全人源单克隆抗体,于2018年5月获美国食品药品管理局(FDA)批准上市,用于预防成人偏头痛,此后相继在欧盟和日本获批。2021年3月,诺华宣布名为DRAGON的Ⅲ期临床试验取得积极结果,达到主要终点。结果显示,依瑞奈尤单抗治疗组在12周双盲治疗期最后4周相比基线减少每月偏头痛天数(MMD)显著优于安慰剂组。
艾夫糖苷酶α是赛诺菲旗下Genzyme公司研发的一种酶替代药物,可以靶向6-磷酸甘露糖受体,从而改善酸性α葡萄糖苷酶(GAA)向肌肉细胞的递送,使多余的糖原得以分解,减少对庞贝病患者肌肉细胞的损伤。该药此前于2021年8月和2022年6月在美国和欧盟获批上市。
美国上市4款新药
9月份,美国批准上市4款新药,根据Pharmadigger数据库,均为全球首次批准(详见表2)。
Nedosiran是诺和诺德通过收购Dicerna制药公司获得的一种RNAi疗法,用于治疗原发性高草酸尿症。该药物通过抑制肝乳酸脱氢酶(LDH)的表达,减少草酸盐的过度生成。草酸盐过量积累可导致肾结石、肾钙质沉着症和慢性肾病。本次FDA批准基于名为PHYOXTM2的Ⅱ期临床试验和正在进行中的名为PHYOXTM3的Ⅲ期临床试验的中期数据。结果显示,PHYOXTM2达到主要终点,接受Nedosiran的患者从第90天至第180天的24小时尿草酸排泄量与基线相较显著减少。
Gepirone是Fabre-Kramer公司开发的一种创新口服血清素(5HT)1A受体激动剂,用于治疗成人重度抑郁症。该药本次获批基于两项随机双盲、安慰剂对照的关键性临床试验,结果显示,与安慰剂相比,Gepirone显著改善了患者的汉密尔顿抑郁量表(HAMD-17)总分。
Momelotinib是Sierra Oncology公司开发的JAK抑制剂。2022年7月,GSK宣布完成对Sierra Oncology公司的收购,获得这款在研药物的开发权益。在治疗骨髓纤维化患者的一项关键性Ⅲ期临床试验中,Momelotinib达到所有主要和关键次要终点,治疗24周时,Momelotinib治疗组在缓解症状、脾脏应答和控制贫血方面较对照组具有统计学显著性的改善,且这一改善具有临床价值。
Motixafortide是BioLineRx公司研发的一款创新CXCR4抑制剂。该药本次获批是基于名为GENESIS的Ⅲ期临床试验,结果显示在非格司亭(Filgrastim) 的基础上加用Motixafortide,使大多数患者能够在单次给药中实现采集≥600万个造血干细胞的目标,且该药物与非格司亭组合显示了良好的耐受性以及安全性特征。Motixafortide是10年来首个在多发性骨髓瘤干细胞动员方面获得FDA批准的创新药物。
欧盟上市6款新药
9月份,欧盟批准了6款新药上市,根据Pharmadigger数据库,均非全球首次批准(详见表3)。
Epcoritamab是艾伯维研发的一种IgG1双特异性抗体,采用Genmab的DuoBody-CD3技术选择性地引导细胞毒性T细胞对目标细胞类型产生免疫反应。它同时结合T细胞上的CD3和B细胞上的CD20,并引发T细胞介导的CD20+细胞杀伤。Epcoritamab此前已于今年5月在美国获批上市。
Crisantaspase是Jazz制药研发的一种源自欧文氏菌的新型天冬酰胺酶,通过催化L-天冬酰胺转化为天冬氨酸和氨的反应来消耗血浆中的天冬酰胺。该药物采用了新一代重组技术进行开发,其安全性与其他天冬酰胺酶制剂相一致。L-天冬酰胺是一种重要的氨基酸,其缺乏会导致白血病细胞无法获得足够的营养,从而选择性地杀死这些细胞。Crisantaspase此前已于2021年6月在美国获批上市。
Ritlecitinib是辉瑞研发的一款每日1次的口服特异性Janus激酶3(JAK3)抑制剂,可阻断导致斑秃的信号分子和免疫细胞活性,从而抑制免疫系统杀伤毛囊细胞,以达到治疗斑秃的目的。该药本次获批是基于名为ALLEGRO的Ⅱb/Ⅲ期临床试验,结果显示,每日服用50mg Ritlecitinib治疗24周后,约15%的患者达到头皮毛发覆盖率≥90%,显著高于安慰剂组。该药此前于今年6月在美国获批上市。
Gefapixant是默沙东研发的选择性P2X3受体拮抗剂,P2X3受体属于嘌呤类受体家族中的配体门控离子通道。研究表明,P2X3受体的过度活化与感觉神经元的超敏化有关。气道和肺部神经元在损伤或感染引起的情况下会出现超敏反应,导致过度、持续和频繁的咳嗽。此外,P2X3受体还特异性地表达于初级感受神经元上,在其高表达和激活的情况下,可以导致慢性疼痛模型动物中的痛觉敏化,从而影响生理性和病理性痛觉调节。该药此前已于2022年1月在日本获批上市。
Elacestrant是Stemline研发的口服选择性雌激素受体降解剂。本次获批是基于名为EMERALD的Ⅲ期临床试验,结果显示,与标准治疗相比,接受Elacestrant治疗的患者无进展生存期具有显著的统计学意义。该药此前已于今年1月在美国获批上市。
替雷利珠单抗是百济神州自主研发的PD-1抗体,本次获批是中国原研PD-1抗体药物首次在欧美市场获得批准。该药本次获批基于名为RATIONALE 302的临床研究,结果显示,替雷利珠单抗治疗组与化疗组相比,患者具有显著统计学及临床意义的总生存期(OS)获益,中位数OS分别为8.6和6.3个月。此外,美国FDA也已经受理替雷利珠单抗的一项上市许可申请,用于一线治疗不可切除的局部晚期、复发或转移性的ESCC患者。该药此前已于2019年在中国获批上市。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐