2024年3月份中美欧批准上市新药盘点:国内首款在中美欧均获批的创新生物药面世
- 2024-04-30 11:16
- 作者:陈倩
- 来源:中国医药报
今年3月份中美欧批准上市的10款新药中,共有5款属于全球首次获批上市的新药。值得关注的是,妥拉美替尼是全球首个获批用于NRAS(神经母细胞瘤RAS病毒致癌基因同源物)突变黑色素瘤的靶向药物。
此外,亿帆医药自主研发的艾贝格司亭α继2023年11月在美国获批上市后,今年3月份在欧盟获批上市,成为国内首个在中美欧三地获批上市的创新生物药;百济神州研发的替雷利珠单抗在美国获批上市,成为第二款成功出海美国的国产PD-1抗体药物。
中国批准一款新药上市
3月份,我国批准了一款新药上市。根据Pharmadigger数据库,妥拉美替尼是全球范围内首次获批上市的新药。
妥拉美替尼(商品名:科露平)是科州制药研发的一款针对NRAS突变的ATP非竞争性选择性丝裂原活化蛋白激酶激酶1和2(MEK1/2)抑制剂,用于含抗PD-1/PD-L1治疗失败的NRAS突变晚期黑色素瘤患者,通过优先审评审批程序附条件批准上市。恶性黑色素瘤是起源于表皮黑色素细胞或色素痣的一种高度恶性肿瘤,多发生于皮肤,居皮肤恶性肿瘤第三位。我国每年新发黑色素瘤患者约20000人,中位发病年龄50~69岁,NRAS突变黑色素瘤是一种侵袭性强、恶性程度高、进展迅速的亚型,约占所有黑色素瘤的10.4%~12.6%。NRAS突变黑色素瘤对免疫和化疗敏感性差。MEK是细胞信号通路RAS-RAF-MEK-ERK的关键环节,MEK抑制剂能通过抑制MEK酶活性,阻断肿瘤细胞的生长、侵袭和转移。
妥拉美替尼本次获批基于一项多中心Ⅱ期关键注册临床研究。该研究共纳入100例晚期NRAS突变黑色素瘤患者,主要研究终点经独立影像评估委员会确认,患者客观缓解率(ORR)为34.7%,中位无进展生存期(PFS)约为4个月,在既往接受过免疫治疗患者中也获得类似的ORR。
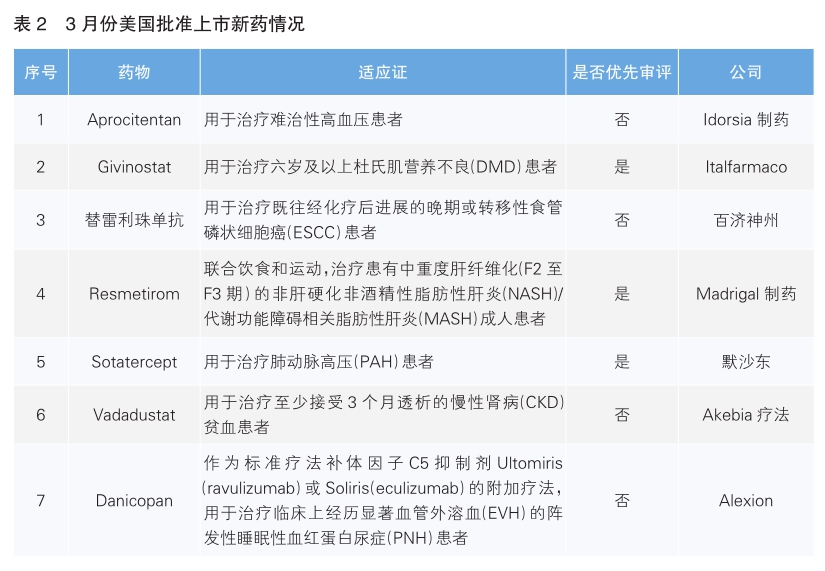
美国批准七款新药上市
3月份,美国批准了7款新药上市。根据Pharmadigger数据库,全球范围内首次获批上市的新药为Aprocitentan、Givinostat、Resmetirom和Sotatercept。
Aprocitentan(商品名:Tryvio)是Idorsia公司与杨森合作研发的一款新型口服双重内皮素A/B受体(ETA/ETB)拮抗剂,可有效抑制ET-1与ETA和ETB的结合,用于治疗难治性高血压患者。Aprocitentan是马昔腾坦的活性代谢产物,具有更长的半衰期,是近30年来获批的首个基于新机制的降血压药物;除了具有潜力抑制内皮素通路外,与其他药物产生药物间相互作用的几率较低。该药本次批准主要是基于名为PRECISION的Ⅲ期临床研究。结果显示,Aprocitentan组患者的坐位收缩压(SiSBP)降低幅度显著大于安慰剂组;从安慰剂转换接受Aprocitentan治疗的患者,在2周内迅速达到了相同的血压下降幅度。
Givinostat(商品名:Duvyzat)是一款由Italfarmaco公司研发的首个获批可用于治疗所有杜氏肌营养不良(DMD)基因变异患者的非类固醇疗法。DMD是一种由编码抗肌萎缩蛋白(dystrophin)的基因突变引起的疾病,患者经历着一系列有害的生理变化,包括肌肉进行性退化、再生能力减弱、肌卫星细胞耗尽等,最终导致运动能力的丧失。在DMD患者的肌肉组织中,组蛋白去乙酰化酶(HDAC)活性异常升高,这种升高的HDAC活性可能促使肌肉再生受损,并妨碍肌肉超细纤维适应收缩的能力。Givinostat的机制与其他获批或正在开发中的DMD治疗药物(这些药物包含类固醇和旨在恢复抗肌萎缩蛋白表达的疗法)不同,旨在通过抑制DMD患者中异常升高的HDAC活性,缓解肌肉组织的损害,保护肌肉超细纤维的功能,从而为患者提供一种全新的治疗策略。该药本次获批是基于一项随机双盲、安慰剂对照的Ⅲ期临床试验。研究结果显示,患者在接受18个月的Givinostat治疗后,计时运动功能有显著改善。
Tislelizumab(中文名:替雷利珠单抗;商品名:Tevimbra)是由百济神州公司研发的PD-1抗体药物,用于治疗既往经化疗后进展的晚期或转移性食管磷状细胞癌(ESCC)患者。该药本次获批是基于名为RATIONALE 302的临床试验。结果显示,替雷利珠单抗组的ESCC患者中位总生存期相比化疗组延长约2个月。美国食品药品管理局(FDA)还在审评替雷利珠单抗作为一线疗法用于治疗不可切除、复发、局部晚期或转移性ESCC患者,以及局部晚期不可切除或转移性胃或胃食管交界处(G/GEJ)腺癌患者的上市申请。
Resmetirom(商品名:Rezdiffra)是Madrigal制药研发的首款每日一次口服甲状腺激素受体(THR)-β选择性激动剂,也是获得FDA批准的首款NASH疗法,用于治疗患有中重度肝纤维化(F2至F3期)的非肝硬化非酒精性脂肪性肝炎(NASH)/代谢功能障碍相关脂肪性肝炎(MASH)成人患者。甲状腺激素通过激活肝细胞中的β受体,在肝功能中发挥核心作用,影响从血清胆固醇和甘油三酯水平,到肝脏中脂肪病理性积聚等一系列健康参数。Resmetirom具有高选择性,能够避免激活介导肝脏外(包括心脏和骨骼)甲状腺激素活性的THR-α受体,并且在肝脏部位被特异性摄取。名为MAESTRONASH的临床试验是首个在NASH患者中达到FDA提出的两个主要终点的Ⅲ期临床试验。试验结果显示,Resmetirom治疗组患者相对于安慰剂组均显著实现了NASH症状消除且肝纤维化未恶化,和纤维化至少一个阶段的改善,且NAFLD活动评分没有恶化。
Sotatercept(商品名:Winrevair)是默沙东研发的首款ⅡA型激活素受体(ActR-ⅡA)融合蛋白,也是首款获得突破性疗法认定的肺动脉高压疗法。2021年10月,默沙东以115亿美元收购Acceleron以获得该产品。Sotatercept将Act R-ⅡA经过改造的细胞外域与抗体的Fc端融合在一起,可以阻断激活素与细胞膜上的受体结合,从而降低激活素介导的信号传导。在临床前实验中显示,该药物可以逆转肺动脉壁和右心室的重塑。该药本次获批上市是基于一项名为STELLAR的随机双盲安慰剂对照的Ⅲ期临床试验。结果显示,在接受治疗24周后,与安慰剂组相比,Sotatercept与稳定背景治疗联用组的患者的6分钟行走距离具有了统计显著并且具有临床意义的改善。
Vadadustat (商品名:Vafseo)是Akebia疗法公司研发的一款小分子缺氧诱导因子-1脯氨酰羟化酶(HIF-PH)抑制剂,通过增加内源性促红细胞生成素的产生,改善铁的吸收和动员以及下调铁调素来促进红细胞生成。该药本次获批主要是基于名为INNO2 VATE的临床研究的疗效和安全性数据,以及日本上市后的安全性数据评估。研究结果显示,Vadadustat相较于达依泊汀α,Hb相较基线的平均变化,达到非劣效性。Vadadustat此前已于2020年6月在日本获批上市。
Danicopan(商品名:Voydeya)是阿斯利康旗下公司Alexion的口服补体因子D抑制剂,可选择性地抑制替代通路中的关键补体因子D,阻断C3转化酶的产生以抑制替代通路的活性。与C5抑制剂不同,Danicopan阻止C3b片段在患者红细胞上的沉积,从而控制PNH患者的红细胞溶解与血管外溶血,并进一步改善患者的治疗效果。该药本次批准基于安慰剂对照的双盲Ⅲ期临床试验。结果显示,与安慰剂组相比,Danicopan与Ultomiris或Soliris组合治疗的患者在12周时的血红蛋白相对基线的变化量显著改善。Danicopan此前已于今年1月在日本获批上市。
欧盟批准两款新药上市
3月份,欧盟批准了两款新药上市,根据Pharmadigger数据库,均非全球首次批准上市的新药。
Cefepime/enmetazobactam(中文名:头孢吡肟+恩美他唑巴坦;商品名:Exblifep)是由Allecra与Advanz制药联合研发的头孢吡肟(一种头孢菌素类抗菌药物)和恩美他唑巴坦(一种β-内酰胺酶抑制剂)的静脉注射用固定剂量抗生素组合,旨在克服革兰阴性细菌中的抗生素耐药性。该药物已于今年2月份获美国FDA批准上市。
Efbemalenograstimalfa(中文名:艾贝格司亭α;商品名:Ryzneuta)是亿帆医药控股子公司亿一生物(EviveBiotech)自主研发的集落刺激因子(G-CSF),是中国唯一一款同时在中国、美国和欧盟获批的长效G-CSF产品。G-CSF类药物为目前临床主要的升白药(提升体内白细胞数的药物),为肿瘤患者在接受抗癌药物后出现的中性粒细胞减少症的刚需用药,也是ASCO(美国临床肿瘤学会)等指南推荐的首选临床用药。艾贝格司亭α此前于2023年5月在我国获批上市,2023年11月获美国FDA批准上市。(陈倩)
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐