7月份中美欧批准上市新药盘点 我国自主研发的六款新药在全球范围内首次获批上市
- 2025-09-11 09:41
- 作者:陈倩
- 来源:中国医药报
7月份,中美欧批准上市的新药中,中国批准的新药数量最多,为7款;美国批准6款;欧盟批准3款新药上市。
中国批准七款新药上市
7月份,我国共批准7款新药上市。根据Pharmadigger数据库,除了恩考芬尼胶囊以外,其余6款均为全球范围内首次批准上市的新药,且均为我国企业自主研发。(详见表1)
雷尼基奥仑赛注射液(商品名:恒凯莱)是恒润达生自主研发的一款靶向CD19的CAR-T疗法。该疗法利用基因工程技术,使CAR分子表达于T细胞表面,从而特异性识别肿瘤细胞表面的CD19抗原,并通过其胞内结构激活免疫反应,杀伤肿瘤细胞。该药本次获批基于Ⅱ期HRAIN01-NHL01-Ⅱ研究,该研究共纳入81例复发/难治性非霍奇金淋巴瘤患者。结果显示,治疗后3个月时约有50%的患者达到客观缓解。
盐酸妥诺达非片(商品名:泰妥妥)是扬子江药业自主研发的磷酸二酯酶5(PDE5)抑制剂。该药在分子结构上具有创新性突破,相较于同类产品,其对PDE5及其他同工酶(如PDE1、PDE6)的选择性更高。
重组人白蛋白注射液(水稻)(商品名:奥福民)是禾元生物运用植物分子医药技术研发的药物,采用了创新的水稻胚乳细胞生物反应器表达体系。相较于酵母表达体系,水稻胚乳细胞表达体系具有安全性好、免疫原性低、成本较低,以及制造过程绿色环保等特点。该药本次获批基于Ⅲ期HY1001-2022-P3研究数据,主要终点为治疗期间血清白蛋白浓度达到35g/L及以上的受试者比例。结果显示,该药的疗效不劣于对照用人血清白蛋白。
玛硒洛沙韦片(商品名:济可舒)是征祥医药自主研发的新一代聚合酶酸性蛋白(PA)核酸内切酶抑制剂,具有广谱抗流感病毒的特性。该药本次获批基于一项Ⅱ/Ⅲ期临床试验,结果显示,该药全病程仅需服用1次,与安慰剂组相比,能显著缩短流感症状中位缓解时间及流感病毒RNA转阴时间。
利沙托克拉片(商品名:利生妥)是亚盛药业自主研发的新型口服Bcl-2选择性抑制剂,通过选择性抑制Bcl-2蛋白,恢复癌细胞的正常凋亡过程,从而发挥抗肿瘤作用。该药本次获批基于一项在中国开展的Ⅱ期临床研究,结果显示,患者的客观缓解率达到预设终点,且研究期间未出现肿瘤溶解综合征,血液系统毒性发生率低且可控。
盐酸司美那非片(商品名:昂伟达)是旺山旺水生物自主研发的PDE抑制剂。该药本次获批基于一项随机、双盲、安慰剂平行对照的Ⅲ期临床试验,该试验共纳入765例男性勃起功能障碍患者,分别给予2.5mg、5mg、10mg剂量的盐酸司美那非或安慰剂治疗12周。结果表明,盐酸司美那非各剂量组对勃起功能改善程度、阴茎插入成功率和勃起维持成功率均显著优于安慰剂组。
恩考芬尼胶囊(商品名:毕太维)是皮尔法伯从辉瑞引进的靶向BRAF V600E的口服小分子激酶抑制剂,通过抑制肿瘤细胞中表达多种突变形式的BRAF激酶(包括V600E)的RAF/ MEK/ERK通路发挥作用,该通路中蛋白质的异常激活已被证实与结直肠癌等多种癌症的发生发展相关。该药本次获批基于关键性Ⅲ期BEACON CRC试验及在中国开展的桥接试验NAUTICAL CRC数据。BEACON研究显示,恩考芬尼联合西妥昔单抗可使BRAF V600E突变型转移性结直肠癌患者的死亡风险降低约40%;NAUTICAL研究中,该联合方案的死亡风险降低约 45%。
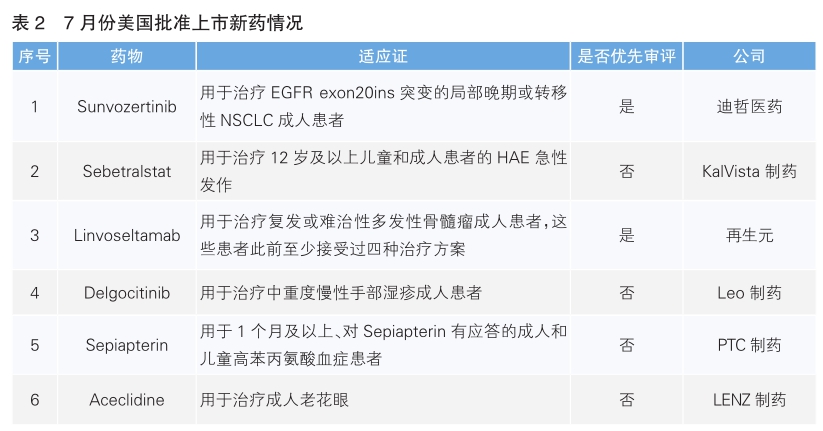
美国批准六款新药上市
7月份,美国批准上市6款新药。根据Pharmadigger数据库,Sebetralstat和Aceclidine为全球范围内首次批准。(详见表2)
Sunvozertinib(商品名:Zegfrovy)是迪哲医药自主研发的一款口服、不可逆、针对多种EGFR突变亚型的高选择性EGFR酪氨酸激酶抑制剂。EGFR exon20ins突变型非小细胞肺癌(NSCLC)患者预后较差,真实世界研究中1年无进展生存率仅为13%。该药本次获批基于WU-KONG1B研究数据,结果显示,约有一半的患者获得客观缓解,缓解持续中位时间为11.1个月。Sunvozertinib已于2023年8月在中国获批上市。
Sebetralstat(商品名:Ekterly)是KalVista制药自主研发的新型口服血浆激肽释放酶(PKK)抑制剂,针对遗传性血管水肿(HAE)的发病机制设计——通过抑制因C1酯酶抑制剂(C1INH)蛋白缺乏或功能障碍导致的PKK-激肽系统过度激活,减少全身组织肿胀的发生。该药本次获批基于Ⅲ期KONFIDENT研究数据,结果显示,Sebetralstat(300mg和600mg)组的症状缓解开始时间和发作严重程度降低时间,均显著快于安慰剂组。
Linvoseltamab(商品名:Lynozyfic)是再生元自主研发的一款BCMA/CD3靶向双特异性抗体,旨在将多发性骨髓瘤细胞上的BCMA与T细胞表面表达的CD3连接,以促进T细胞活化和癌细胞杀伤。该药本次获批主要基于关键性Ⅰ/Ⅱ期LINKER-MM1试验,结果显示,患者的客观缓解率达70%,其中45%的患者达到完全缓解或更佳的应答。Linvosel t amab此前已于2025年4月30日在欧盟获批。
Delgocitinib(商品名:Anzupgo)是Leo制药自主研发的局部泛JAK抑制剂,用于治疗慢性手部湿疹成人患者。慢性手部湿疹是一种异质性、反复发作的炎症性皮肤病,主要症状包括瘙痒和疼痛,常伴随皮肤屏障功能障碍、炎症及微生物群改变。该药本次获批基于DELTA 1和DELTA 2两项Ⅲ期临床试验,结果显示,第16周时Delgocitinib组达到IGA-CHE治疗成功标准的比例,显著高于载体对照组。Delgocitinib最早于2020年1月在日本获批上市。
Sepiapterin(商品名:Sephience)是PTC制药自主研发的一种口服制剂,具有双重作用机制,以提高苯丙氨酸羟化酶(PAH)的活性。Sepiapterin是一种前体化合物,能够迅速被吸收并在细胞内转化为四氢生物蝶呤(BH4),这是一种关键的PAH辅助因子。该药本次获批主要基于一项Ⅲ期临床试验,结果显示,接受Sepiapterin治疗的患者平均苯丙氨酸减少63%。该药已于2025年6月在欧盟获批上市。
Aceclidine(商品名:Vizz)是LENZ制药自主研发的一种不含防腐剂、每日使用1次的眼药水,旨在为患者提供长达10小时的清晰近视力。Aceclidine是一种乙酰胆碱受体激动剂,能使瞳孔收缩至2毫米以下,产生针孔效应,从而提升近距离视觉清晰度。该药本次获批主要基于3项随机、双盲、对照的Ⅲ期临床试验,结果显示,Aceclidine在所有主要及次要的近视力改善指标上均达标,可于用药30分钟内起效,并持续改善视力达10小时。
欧盟批准三款新药上市
7月份,欧盟批准3款新药上市。根据Pharmadigger数据库,均非全球范围内首次批准。(详见表3)
Inavolisib(商品名:Itovebi)是罗氏自主研发的一款口服、高选择性PI3Kα抑制剂。相较于其他PI3K亚型(如PI3Kβ、PI3Kδ、PI3Kγ),Inavolisib对PI3Kα具有更高的选择性与抑制效力,且能够特异性促进突变型PI3Kα蛋白的降解,从而抑制相关信号通路的异常激活。该药最早于2024年10月在美国获批上市。
Obecabtagene autoleucel(商品名:Aucatzyl)是Autolus研发的靶向CD19的CAR-T细胞疗法。其采用中等亲和力的CAR设计,在确保疗效的同时,有效降低治疗相关毒性,并提升CAR-T细胞的持久性。该药最早于2024年11月在美国获批上市。
Mirdametinib(商品名:Gomekli)是SpringWorks研发的一种口服小分子MEK抑制剂,可抑制MEK-1和MEK-2的激活。MEK作为RAS/MAPK信号通路中的关键组分,在神经纤维瘤1型(NF1)患者中常因NF1基因突变而导致该通路异常激活,进而引发疾病。Mirdametinib最早于2025年2月在美国获批上市。
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐