我国生物类似药发展机遇与挑战并存
- 作者:
- 来源:中国医药报
- 2015-12-29 10:25
今年上半年,国家食品药品监督管理总局(CFDA)发布《生物类似药研发与评价技术指导原则(试行)》,对生物类似药的申报程序、注册类别和申报资料等进行了规范。生物类似药的发展主要源于巨大的未被满足的医疗需求及市场对高质量但相对价格低廉药物的需要,而近几年很多生物制品(尤其是单抗)专利即将到期以及生物技术的发展,更为生物类似药的发展提供了现实的可能。近日,汤森路透发布了《2015年中国生物类似药发展报告》白皮书,利用汤森路透Cortellis竞争情报数据库,从数据的角度汇总和分析当前全球尤其是我国生物类似药领域的进展和趋势。本文摘自该白皮书,以期使读者了解我国生物类似药的研发概貌,帮助研发人员开发高水平高质量的生物类似药。
国内快递进军生物类似药领域
汤森路透Cortellis竞争情报数据库的数据分析显示,我国是拥有生物类似药研发数量最多的国家,已经超过印度,反映出行业对于我国生物类似药发展的强烈预期。而生物类似药的发展,无疑将会弥补我国巨大的未被满足的临床需求,尤其是在糖尿病、肿瘤、免疫系统疾病等治疗领域。
目前,在Cortellis竞争情报数据库的研发管线中,约有270个生物类似药在我国研发。其中,约有一半处于临床前研究阶段,其中65个提交临床申请(大部分是在2014年以后提交),10个已经获得临床批件,有望于近期开展临床试验。有44个生物类似药处于临床研发阶段,其中上海复宏汉霖的利妥昔单抗、通化东宝的甘精胰岛素等13个生物类似药处于临床Ⅲ期。此外,中信国健的曲妥珠单抗、华兰基因工程的曲妥珠单抗、上海百迈博的英夫利昔单抗等13个生物类似药提交了上市申请。
随着留学归国人员的回归、VC 的介入、生产技术的发展以及国家政策的影响,国内许多公司开始涉足生物类似药领域。其中,既有如齐鲁制药、海正药业、双鹭药业这样的老牌公司,也有如苏州康宁杰瑞、上海复旦张江生物这样的新秀。苏州康宁杰瑞、齐鲁制药、哈药集团生物工程有限公司、厦门特宝、中信国健、上海复宏汉霖、嘉和生物、双鹭药业、海正药业及通化东宝等是目前拥有生物类似药研发数量相对较多的公司。
由此可见,近几年来,特别是近两年国内企业快速向生物类似药领域尤其单抗市场进军,目前已经初步形成了竞争。但是,由于生物类似药研发周期相对较长,可能需要5~10年的时间获得生产批件,因此这一领域还有很大的发展空间。此外,外资企业如安进、礼来也在我国生物类似药市场布局,这些都是本土企业面临的竞争。
单克隆抗体成为竞争焦点
我国传统的重组蛋白药物,如细胞集落刺激因子、促红素、干扰素、白介素、生长因子在上个世纪90年代都已经获批上市,竞争激烈。单克隆抗体包括肿瘤坏死因子(TNF)受体抗体发展潜力巨大,已经成为我国许多企业竞争的主要领域,约占整个生物类似药总量的50%。
值得一提的是,目前我国的单克隆抗体处于发展初期,大部分处于临床前研发阶段,只有22个单抗产品上市,其中进口产品12个,国产品种10个。国产抗体中,中信国健的TNF-α受体抑制剂依那西普单抗(益赛普,Etanercept),2006年在我国批准上市,用于治疗类风湿性关节炎、强直性脊柱炎,并于2013年在印度、墨西哥和哥伦比亚上市。此外,百泰生物的尼妥珠单抗市场表现也值得关注。
目前,依那西普及其生物类似药在我国竞争比较激烈。除益赛普外,上海赛金的同类品种强克2012年上市用于强直性脊柱炎,而用于风湿性关节炎的Ⅲ期临床已经结束;今年1月,用于治疗银屑病的Ⅲ期临床试验在261名受试者中开始。今年4月,海正药业的同类品种安佰诺也已经获批。
在我国单抗市场,最早在国内布局的中信国健产品线相对比较成熟,除了已经上市的益赛普、健尼哌外,曲妥珠单抗、利妥昔单抗已经提交上市申请。上海复宏汉霖主要致力于单抗的创新药和生物类似药的研发。利妥昔单抗类似药(HLX-01)用于治疗非霍奇金氏淋巴瘤的Ⅲ期临床试验已于今年3月开展;西妥昔单抗类似药(HLX-05)、贝伐珠单抗类似药(HLX-04)、阿达木单抗类似药(HLX-03)已经提交临床申请;曲妥珠单抗类似药(HLX-02)和帕妥珠单抗类似药(HLX-11)目前处于临床前研究阶段。
机遇之中仍有挑战
伴随着《生物类似药研发与评价技术指导原则(试行)》的出台,生物类似药的审批流程将会规范与简化,而且目前的药品上市许可持有人制度,以及特殊审批通道、税收优惠等相关政策,为我国生物类似药的发展提供了前所未有的发展机会。虽然目前我国的生物药占医药行业的比重相对较低,但发展潜力巨大,国内许多企业已经在生物类似药的浪潮中布局。在生物类似药核心专利中,我国的专利数量紧随美国及欧盟。
除了进行生物类似药的自主研发与产业化之外,我国企业也在寻求各方面的合作机会。在我国生物类似药的交易中,药物研发及商业许可的交易类型占比最高,有21项。2013年5 月,华海药业从Oncobiologics Inc购买了阿达木单抗、贝伐珠单抗、曲妥珠单抗及利妥昔单抗类似药的中国许可,并在美国设立合资公司,共同开发这4个单抗药物,以期华丽转身,迅速在单抗市场中占据一席之地。而在今年上半年宣布的苏州信达生物和美国礼来的重磅合作中,也可以看到生物类似药的身影。
虽然开发生物类似药意义重大,但其在研发和生产中仍面临诸多挑战。比如,生物药因其生产工艺的独特性,使其无法被其他厂家完全复制,用于证实两种化学药相同的方法不完全适用于生物药。从全球生物类似药的专利类型比较中,我们也可以看到,对于生物类似药的技术保护主要集中在剂型与工艺两个方面。因生物类似药具有独特的空间结构,蛋白质结构并不完全明确,细微的工艺变化就有可能使其受到影响,进而影响产品的安全性和有效性。此外,除了指导原则之外,政府也需要进一步出台相关细则,以促进生物类似药产业的快速发展。(本文由汤森路透提供)
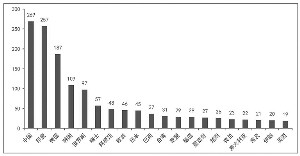 生物类似药研发分布的主要国家和地区(来源:汤森路透CORTELLIS 竞争情报数据库,2015-11-09)
生物类似药研发分布的主要国家和地区(来源:汤森路透CORTELLIS 竞争情报数据库,2015-11-09)
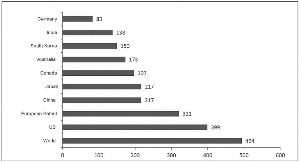 生物类似药核心专利集中的主要国家和地区(来源:汤森路透CORTELLIS 竞争情报数据库,2015-06-09)
生物类似药核心专利集中的主要国家和地区(来源:汤森路透CORTELLIS 竞争情报数据库,2015-06-09)
相关链接
CFDA发布的《生物类似药研发与评价技术指导原则(试行)》中指出,生物类似药是指“在质量、安全性和有效性方面与已获准注册的参照药(通常为原研产品)具有相似性的治疗用生物制品”。一般来讲,生物类似药是在原创性生物药产品专利保护到期后,生产的区别于原研产品的类似物。然而,由于生物类似药通常是一类大分子蛋白异构体的集合,有效成分比较复杂,不像传统化学仿制药是结构比较明确的化学分子。因此,生物药的仿制药和原创药有效成分基本不可能做到完全一致,于是才有了生物仿制药或生物类似药的概念。
(责任编辑:)
分享至
右键点击另存二维码!
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有


dac00ec8-88f7-45fd-9248-d0bb4b6a357e_260x150c.jpg)




