2015年全球新药光荣榜
- 作者:
- 来源:中国医药报
- 2016-01-12 10:11
2015年,无论是从全球整体来看,还是从局部国家来看,新药研发热情依旧不减,新药产出数量和质量可圈可点。即日起,本版特开辟“2015年新药研发回顾”专栏,在翔实数据的基础上,分别介绍2015年全球、美国和我国新药研发的情况,为研发人员提供相关信息,敬请关注。
根据汤森路透数据显示,截至2015年12月15日,全球共有49个新分子实体(NME)和生物药首次获批并推向市场;在全球已上市药物中,有29个重要的产品线延伸首次获得批准,包括新适应证、新剂型或者新复方;有21个NME在全球首次获批,但还未上市。
虽然这些数字表明制药和生物技术行业整体上运行良好,但是与2014年的59个上市新药相比,上市新药数量有明显下降。不过,质量远比数量更为重要,在2015年上市的新药中,的确有一些非常杰出的“成员”。
抗癌新药
对于癌症患者来说,2015年非常值得庆贺,因为这一年是最近10年来全球范围内上市癌症治疗新药数量最多的一年,共有14个新的癌症治疗药物首次推向市场。
其中,2015年有4个治疗多发性骨髓瘤的新药获批并上市。在此之前,已经有10年无多发性骨髓瘤治疗新药上市,市场上仅有屈指可数的几个治疗药物。借用多发性骨髓瘤研究基金会(Multiple Myeloma Research Foundation)主席Walter Capone的话来说,2015年,对于美国9万名这一罕见血液癌症的患者来说,是个“分水岭”。
用于之前无药可治疾病的新药
2015年,有一些用于之前无药可治的疾病的新药上市。其中,一部分用于常见病,另一些则用于极为罕见的疾病。
这类药物中,甲磺酸赖氨酸安非他命(Vyvanse)是首个用于成人中度至重度暴食症的药物。在美国,估计有280万名成人患有暴食症,是这个国家最常见的饮食失调疾病。
美国患者也将率先用上氟班色林(Addyi),它是首个治疗女性性欲减退疾病的药物。在两次拒绝新药申请(NDA)后,2015年美国食品药品管理局(FDA)最终批准了这个产品,不过因为潜在的严重副作用,在使用上加以严格的限制。这个药物的批准引发了争议,最近FDA在《新英格兰医学杂志》上阐述了该机构作出批准决定的原因。
罕见出血性疾病遗传性凝血因子X缺陷症在美国仅有400~600名患者,对于这些患者来说,2015年是值得铭记的一年,用于这一疾病的专门治疗药物终于面世:BPL公司的人源化凝血因子X(Coagadex)。此外,2015年,首个用于极罕见致命疾病——低磷酸酯酶症的首个治疗药物Asfotase alfa(Strensiq)在一些国家也获得批准并上市。
另一个有史以来的第一次是,赛诺菲巴斯德公司历时20年开发的4价登革热疫苗(Dengvaxia)于2015年12月中旬在墨西哥首次获得批准,用于居住在疾病流行地区的少年、青少年和成年人预防全部4种血清型的登革热病毒感染。登革热在125个国家流行,每年估计全球有5000万至1亿人被感染。Denvaxia将在2016年上市。
全新作用机制新药
2015年,全球有11个作用机制为全新的创新药推向市场,其中包括2个用于高胆固醇血症的创新药。大约10年前,那些对标准治疗他汀类药物无效的患者,抑制循环蛋白前蛋白转化酶枯草杆菌蛋白酶Kevin 9型(PCSK9)被认为是一个有前途的降低低密度脂蛋白(LDL)胆固醇的新策略。PCSK9通过促进LDL受体降解造成高胆固醇血症,而缺乏该蛋白会导致LDL胆固醇的水平较低,减少心血管疾病的风险。2015年夏天,在开发PCSK9抑制剂的赛跑中,两个抗PCSK9单抗几乎同时获得批准:Evolocumab(Repatha,安进公司)和Alirocumab(Praluent,Regeneron/赛诺菲公司)。
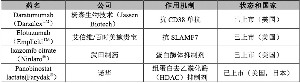
2015年上市的其他首创新药还包括:抗IL-5单抗Mepolizumab(Nucala,葛兰素史克公司),已上市用于哮喘;抗IL-17A单抗Secukinumab(Cosentyx,诺华公司),已上市用于银屑病和银屑病关节炎,已批准用于强制性脊柱炎;抗SLAMF7单抗Elotuzumab(Empliciti,艾伯维/百时美施贵宝公司),已上市用于多发性骨髓瘤;细胞周期蛋白依赖性激酶(CDK)4/6抑制剂Palbociclib(Ibrance,辉瑞公司),已上市用于乳腺癌。(本稿件由汤森路透提供)
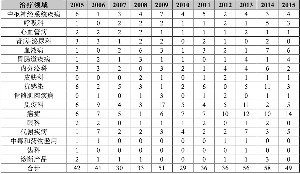
2005~2015年各治疗领域上市新药(不包括产品线延伸)
(责任编辑:)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有


dac00ec8-88f7-45fd-9248-d0bb4b6a357e_260x150c.jpg)




