扫描美国FDA批准上市的66个抗体药物
- 作者:吴文君
- 来源:中国医药报
- 2016-09-07 14:26
抗体类药物已经成为新药研发的重要力量。从技术上看,新型抗体药物层出不穷,双特异性抗体、ADC药物、肿瘤免疫疗法、抗体片段、融合蛋白技术等,诸多新技术推动了抗体药物的发展。抗体药物的应用也已经拓展到癌症、免疫疾病之外更广阔的治疗领域。
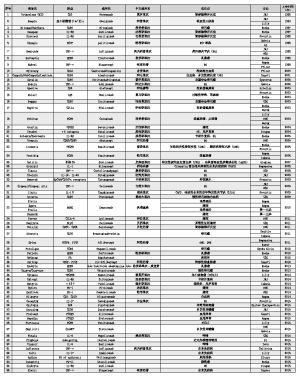
从1992年首个抗体药物Orthoclone上市以来,截至目前,美国食品药品管理局(FDA)共批准上市了66个抗体药物,平均每年上市约2.5个抗体药物,且速度越来越快。如2014年上市了6个抗体药物,2015年上市了9个抗体药物,连续两年打破历史记录。
在这20多年间,抗体药物研发出现诸多“里程碑”:1992年上市了首个鼠源抗体莫罗单抗(Orthoclone,Muromonab),1993年上市了首个嵌合单抗巴利昔单抗(Reopro,Abciximab),1997年上市了首个人源化单抗达利珠单抗(Zenapax,Daclizumab),1998年上市了融合蛋白依那西普(Enbrel,Etanercept),2000年上市了首个ADC药物吉妥单抗(Mylotarg,GemtuzumabOzogamicin),2002年上市了首个全人源单抗阿达木单抗(Humira,Adalimumab),2006年上市了抗体片段雷珠单抗(FabLucentis,Ranibizumab),2009年上市了首个双特异性抗体卡妥索单抗(Removab,Catumaxomab),2011年上市了首个肿瘤免疫治疗抗体伊匹单抗(Yervoy,Ipilimumab),2012年上市了首个PD-1抗体纳武单抗(Opdivo,Nivolumab)。
今年至今,FDA又批准了7个抗体药物。Cinqair为白介素(IL)-5抗体,为第2个获批的同类药物,继葛兰素史克Nucala之后上市。Inflectra为英夫利昔单抗,作为强生Remicade的生物类似药,是FDA批准的第2个生物类似药,也是首个抗体类似药,具有里程碑的意义。Celltrion公司也凭借出色的表现,在抗体类似药领域处于领先位置,这也是韩国多年来着重布局生物制药产业的一个硕果。Taltz为IL-17抗体,为第2个获批的同类药物,继诺华Cosentyx之后上市。Anthim为炭疽病毒PA抗体,经动物体内有效性实验后上市(只进行了临床安全性试验,未进行临床有效性试验,因炭疽感染不可能用人体进行试验)。Tecentriq为PD-L1抗体,是免疫检验点抑制剂领域的又一个里程碑。Zinbryta为达利珠单抗(首个达利珠单抗为罗氏的Zenapax,用于器官移植的免疫抑制)的老药新用,百健通过改变生产工艺,得到去盐藻羰基化组分更低的达利珠单抗,大大减轻了ADCC活性(与多发性硬化症的治疗机制无关),达到减轻副作用的目的。Erelzi为依那西普,是Enbrel的类似药。此前,安进通过“潜水艇专利”将美国市场Enbrel保护期延长至2028年。此次获批,并不意味着Erelzi可以很快上市,恰恰相反,两家公司针锋相对的专利大战将要继续上演。
在近几年新上市的抗体药物中,除了Eylea(融合蛋白),罗氏的Perjeta和ADC药物Kadcyla、BMS的PD-1单抗Opdivo、默沙东的PD-1单抗Keytruda、安进的PCSK9抗体Repatha、赛诺菲的PCSK-9抗体Praluent、诺华的IL-17抗体Cosentyx、武田的Entyvio等都表现出了巨大的商业潜力。
随着今年第一梯队抗体药物的专利相继到期、生物类似药的替代,多股力量交织,未来的抗体药物市场格局还会发生深刻变化。
表 FDA批准上市的抗体药物
(责任编辑:)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有


dac00ec8-88f7-45fd-9248-d0bb4b6a357e_260x150c.jpg)




