日本细胞治疗产品管理及对我国的启示
- 2020-05-06 13:49
- 作者:梁毅
- 来源:微信公众号“药学进展”
[摘要]细胞治疗作为一种突破性的新型治疗方式,对癌症等重大难治性疾病的治疗具有革命性的意义,目前已成为最具潜力的治疗途径之一。多年来,日本一直在细胞治疗产品的技术研发和监管政策方面保持全球领先地位,得益于其完整的法律体系与特殊的审批政策。系统对比中日两国在细胞治疗产品临床管理方面的相关法规、部门责任以及审批路径,为确立安全、规范、稳定、可追溯的细胞治疗产品管理提供借鉴与参考。 2017年1月5日,美国风筝制药(Kite Pharma)对外发布消息称将与日本第一三共株式会社(Daiichi Sankyo Company Limited)签署一项战略合作协议,共同在日本开发CAR-T产品,携手探索癌症治疗方法,并将其在日本市场商业化推广。该协议总金额高达4.5亿美元。目前,全球范围内细胞治疗产业作为战略新兴产业正高速发展,给制药企业和监管机构都带来了前所未有的挑战,其增长热点覆盖了从细胞库到细胞制备、细胞治疗技术研发、细胞临床研究等各个方面。近年来由于人口老龄化问题不断加剧,导致医疗成本不断增加,日本细胞治疗领域发展迅速,行业内也将细胞治疗产品视为其研究型制药业增长的关键驱动因素,而研发领域也屡获突破,从2012—2018年,共有山中伸弥、大隅良典、本庶佑3位日本科学家由于在干细胞、细胞自噬机制、免疫细胞治疗方面取得的突出成果,获得了诺贝尔生理学和医学奖。这一切使得日本在细胞治疗产品研发和政策方面走在全球前列。本文通过介绍日本的细胞治疗产品临床试验管理情况,以期为我国细胞治疗产业的规范性和安全性建设提供建议。 1日本关于细胞治疗产品的概念以及审批和上市情况 1.1日本关于细胞治疗产品的概念 在日本,细胞治疗产品被称为再生医疗产品,是指用于化学治疗、改变生物学特性和进行人工基因操作增殖或激活细胞用于治疗疾病或组织修复再生的含有或由自体或者同源人类细胞或组织组成的药物或医疗器械。日本独立行政法人医药品医疗器械综合机构(PMDA)将其作为独立于药品、医疗器械之外的第三类产品进行监管。 1.2日本细胞治疗产品审批和上市情况 作为细胞治疗产品研发科技强国的日本,截至2017年底,已有2个成体细胞成品上市,分别为JACE公司的自体培养表皮以及JACC公司的自体培养软骨,两者都是通过培养患者自身细胞,随后移植回患者体内的方式进行再生。日本已经上市的干细胞产品分别为JCR制药公司销售的名为Temcell的异体间充质干细胞以及Nipro公司的stemirac的自体间充质干细胞,前者用于造血干细胞移植后的严重并发症之一——急性移植物抗宿主反应(GVHD)的治疗,其于2015年9月获得日本厚生劳动省(MHLW)的完全批准,上市4年来,取得了良好的经济和社会效益;后者于2018年12月获批,用于创伤性脊髓损伤患者,以改善与脊髓损伤相关的神经症状和功能障碍。 肿瘤免疫治疗方面,2018年,诺华制药在日本采购了合同研发生产组织(Contract Development Manufacture Organization,CDMO)服务。2019年2月,MHLW正式批准了诺华研发的CAR-T药物Kymriah,用于治疗CD19阳性复发或难治性(r/r)B细胞急性淋巴细胞白血病(ALL)和CD19阳性r/r弥漫性大B细胞淋巴瘤(DLBCL)。Kymriah亦成为迄今为止第1个在亚洲获得监管批准的针对以上2种B细胞恶性肿瘤的CAR-T疗法。 2日本细胞治疗产品的临床管理概况 2.1监管法规 为了能够建立更加高效的科技成果转化通道,日本的监管机构借鉴了韩国的细胞治疗产品监管法规,在对本国原有的法规进行修订的基础上,建立了日本再生医学比较完善的法律体系。总的来说,日本政府对于细胞治疗产品的技术和产品实行分开管理。关于所有使用加工细胞医疗技术的临床研究的安全性和有效性要求,可参考2014年颁布的《再生医学安全法》(Act on the Safety of Regenerative Medicine,RMAct);而再生医学和细胞治疗产品的生产和上市相关内容应借鉴《药物和医疗器械法案》(Pharmaceutical and Medical Devices Act,PMDAct)。 其中,《再生医学安全法》为再生医疗的监管审批和产品安全提供了重要的法律支撑,其中说明应就对人体健康的影响程度,采用风险评估的三级分层体系,将再生医疗技术分为三类,以确定研究质量监督所需要的水平,具体分类标准如图1所示。对于低风险产品,如加工体细胞,由“认定再生医疗等委员会”进行审查,由申请者向MHLW大臣提交临床试验计划。对高风险的再生医疗产品[包括胚胎干细胞(ESCs)、诱导多能干细胞(iPSCs)]和中等风险的再生医疗产品[包括成体干细胞(SSCs)],医疗机构需要向MHLW指定的专门委员会申请研究许可。对于Ⅰ类(高风险)产品,除了专门委员会的评估,MHLW将在90d内咨询健康科学委员会(Health Science Council),根据健康科学委员会意见作出判断。 除此以外,日本卫生监管部门还出台了一系列研究指南规范,包括《干细胞临床研究指南》、《人体自体细胞/组织产品质量控制与安全指南》等。其中,《干细胞临床研究指南》的临床试验部分包括通则、研究机构的条件与职责、知情同意、临床研究过程等项目。该指南成也为了干细胞临床进行研究性治疗的临床标准。 2.2监管主体部门及其责任 日本细胞治疗产品由PMDA根据《药物和医疗器械法案》进行监管,其药品评估中心下设细胞组织加工制品专门委员会具体负责审批事务。至于某些在取得资质的医疗机构内开展的细胞治疗,将由MHLW依照《再生医学安全法》对其进行监管。 2.3审批路径 在日本,再生医学产品的临床试验根据其申请目的可分为2种(双轨制),注册试验和临床研究。其中,注册试验是以产品上市许可为目的,申请人一般为制药企业,需要向PMDA提交临床试验申请,而临床研究是以医生在医疗机构中给患者施用医疗产品作为研究目的,新技术或新疗法的科学和伦理方面研究以及申请表格只需要提交给临床试验机构的评审委员会,由MHLW监管。
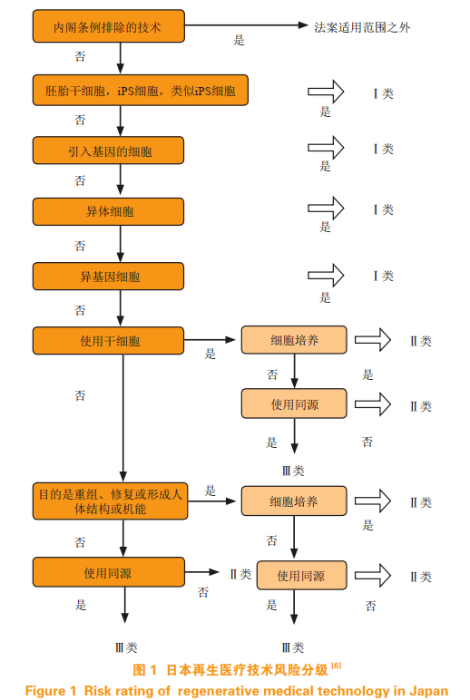
一般而言,在企业提交上市许可申请后,PMDA会依据现有的科技水平对于再生医疗产品的质量、有效性、安全性进行审评,采用30d备案制,30d内如PMDA不发信,则视为批准申请。日本还规定:对于均质性不一的再生医疗等制品,如果能确定其安全性,并且能估计其有效性,那么可以通过附加条件及期限,特别是在早期就可以对其予以承认。然后,再重新验证其安全性和有效性,决定其是作为产品长期上市还是退出市场。但给予批准上市的时限最长不得超过7年。此政策的创新大大加快了再生医学产品的进程,使日本的个性化医疗管理再次向前迈进了一大步。
3我国细胞治疗产品临床管理现状
3.1监管法规
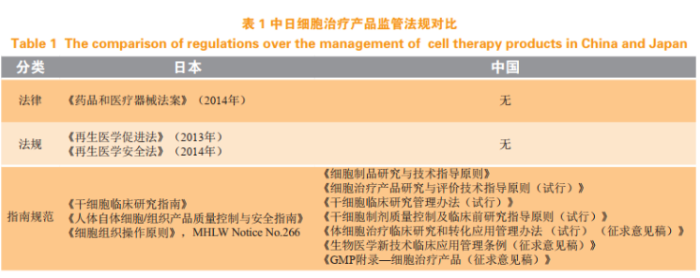
2017年12月,原国家食品药品监督管理总局(CFDA)颁布了《细胞治疗产品研究与评价技术指导原则(试行)》并开始实施。该文件为细胞治疗药品的研发、生产与注册指明了路径,旨在进一步规范细胞治疗产品的研发,提高其安全性、有效性和质量可控性水平。关于临床试验,其中指明:鉴于细胞治疗产品特殊的生物学特性,在临床试验中,需要采取不同于其他药物的临床试验整体策略。而在干细胞临床研究管理方面,2016年原CFDA发布《干细胞临床研究管理办法(试行)》,其中对干细胞临床研究过程及干细胞制剂等作了详细的要求和规范,同时指出干细胞治疗相关技术将不再按照第三类医疗技术进行管理。随即原国家卫生计生委与原CFDA共同成立了国家干细胞临床研究专家委员会,其成员由干细胞基础及临床相关专业、干细胞制剂制备和质量控制等领域33位专家组成,为干细胞临床研究规范管理提供技术支撑。2019年国家卫健委发布了《体细胞治疗临床研究和转化应用管理办法(试行)(征求意见稿)》和《生物医学新技术临床应用管理条例(征求意见稿)》,这2份监管文件主要关注的焦点都是细胞治疗,其明确了医疗机构作为责任主体,可以进行体细胞治疗等新技术的临床研究,在获得安全有效性数据后,可以申请临床应用并收费。为了弥补我国对细胞治疗产品生产和质量检查在法规层面和技术层面的空白,进一步完善细胞治疗产品监管长效机制,国家疫苗检查中心暨国家药品监督管理局(NMPA)食品药品审核查验中心于2019年11月28日发布了《GMP附录-细胞治疗产品》(征求意见稿),适用于从供体材料的运输、接收、产品生产和检验到成品放行、储存和运输的全过程(见表1)。
3.2监管主体部门
一直以来,根据《药品注册管理办法》,细胞治疗产品被归类为生物制品3类新药,按照此类进行申报,药品监督管理司下设的监管三处主要负责生物制品的生产监管。然而,根据卫健委2019年发布的《生物医学新技术临床应用管理条例(征求意见稿)》,对于临床试验的监管实行双轨制,生物医学新技术临床研究实行分级管理。中低风险生物医学新技术的临床研究由省级卫生主管部门管理,高风险生物医学新技术的临床研究由国务院卫生主管部门管理。
3.3审批路径
在我国,细胞治疗产品的注册由申请人向NMPA药品审评中心(CDE)提出,CDE进行研制现场核查后最终作出是否同意审批的决定,如同意审批,则会向临床试验机构颁发《临床试验批件》。
4日本细胞治疗产品法规政策对我国的启示
4.1完善监管法规体系,明确相关部门责任
目前,在法律层面上,关于细胞治疗产品的临床管理,我国仅有一些指导规范和技术原则作出说明,基本法《药品管理法》中对于细胞治疗产品也并无涉及。这些法律文件中更未明确卫生监管部门对于细胞治疗产品管理的具体分工、评审程序和监管权限。所以,想要进一步提高监管的力度与可行性,就必须建立从法律、法规,再到指南的完整健全的法治监管体系。建议设置专门针对于细胞治疗产品管理的机构,并建立专家委员会起到协调与监督的作用。此外,也需要加强卫健委、药监局、科技部、发改委、海关总署等部门的沟通协调,明确各部门责任,加快技术成果转化与应用。
4.2建立风险防控体制,加快市场化进程
鉴于细胞治疗产品具有种类多、差异大、性质复杂多变、研究进展快、技术更新迅速、风险程度不同的特点,对于不同类型产品,可基于风险特征和专项控制措施,采用适合其产品的特有技术。日本以风险管控机制为前提条件及平衡因素,对再生医疗技术以及产品安全性进行严格的把控,以及对受试者利益进行多方面保护。中国也可借鉴其经验,按风险级别对细胞治疗产品进行分类,制定相应的风险控制方案,进行全面且有差异化的管理,提供安全有效的细胞治疗,从而惠及患者。在进行临床试验之前,就可根据细胞的来源、类型、性质、功能、制备工艺复杂程度、体内生物学特性等对于细胞进行风险因素分类,在生产的过程中严格控制,建立良好规范的质量管理体系,降低或规避质量风险,从而保证产品的质量和安全,并完善质量放行检测机制。
4.3建立可追溯管理体系,强化法律问责
细胞治疗产品的生产者应建立产品可追溯的信息化管理体系,以确保产品从供者到受者全过程,全生命周期的可追溯性。规范和监控生产操作过程、从研发、临床试验到生产都有完整清晰的文件记录,并在整个产品生命周期内不断地收集和更新数据,明确和防范风险。一旦发生问题,及时召回,以保障患者的权益。而对于违规开展研究和生产的人员,监管部门应追究其法律责任。
5结语
日本作为细胞治疗技术研发强国之一,细胞治疗产品管理在法规层面和技术层面都有创新之处。而我国细胞治疗产品监管目前还存在法律法规体系不完善、风险防控体制不健全、信息管理追溯不规范等问题。我国可借鉴日本在产品审批上市、临床试验管理等方面的经验,进一步完善细胞治疗产品监管长效机制,提高其安全性、有效性和质量可控性水平,从而推动和促进我国细胞治疗领域的健康发展。(梁毅)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐












