吸入制剂原研垄断,期待首仿
- 2020-06-05 14:25
- 作者:
- 来源:新领先
吸入制剂系指通过特定的装置将药物以雾状形式传输至呼吸道和/或肺部以发挥局部或全身作用的制剂,目前被广泛应用于哮喘和慢性阻塞性肺疾病的治疗,是国内外权威专家共识和诊疗指南推荐剂型。2015 版《中国药典》将吸入制剂作为单独剂型收载,并对其检测指标和检测方法进行了叙述。
吸入制剂优势
吸入制剂根据其给药装置差异可以分为四大类:干粉吸入剂(DPI)、气雾剂(MDI)、雾化吸入溶液(NEB)、喷雾剂。
吸入制剂在临床上有明显优势:
起效迅速。由于人体肺部具有巨大的可用于药物吸收的表面积以及丰富的毛细血管,并且从肺泡表面到毛细血管的运转距离极短,因此药物一旦到达肺泡即可迅速被吸收和转运,故吸入制剂起效迅速。
靶向性,毒副作用小。由于吸入制剂直接作用于肺部,提高药物在靶器官的聚集,因此增加药物疗效的同时减少了药物毒性与不良反应。
生物利用度高。肺部直接入血,无首过效应,生物利用度高。
患者依从性好。气雾剂、干粉剂便于携带,方便患者操作并且剂量准确。
国内外市场快速增长
由于空气污染等原因,全球支气管哮喘(Asthma)和慢性阻塞性肺病(COPD)等呼吸道疾病的发病率呈现持续高增长态势,同时ACOS(重叠综合症)人群也越来越多。据推测,全球有3.6亿人患有支气管哮喘,近3.8亿人患有慢性阻塞性肺病,其中有6500万人患有中重度慢性阻塞性肺病。
国内情况也不容乐观。根据王辰院士团队2019 年在《柳叶刀》杂志发布的《Prevalence, risk factors, and management of asthma in China》显示,我国20岁及以上人群哮喘患病率为4.2%,患者总人数4570万(男性2570万,女性2000万);慢阻肺患病率为8.6%,总人数达有9990万名(男性6840万,女性3150万),其中40岁及以上患病率达到13.7%,男性患者数为女性的2.2倍,COPD已成为仅次于高血压、糖尿病的中国第三大常见慢性病。
IQVIA报告显示,2019年全球吸入制剂的市场份额高达480亿美元,6年复合增长率为6.99%。全球吸入制剂药物的应用场景,主要来自支气管哮喘Asthma/慢阻肺COPD的防治(约93%市场份额)、肺动脉高压治疗,以及吸入麻醉及咳嗽的运用。
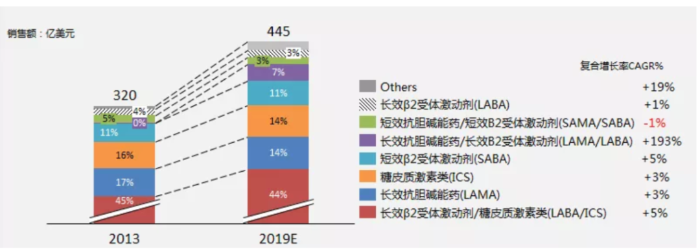
中国城市公立医院统计数据显示,2018年国内气雾剂、喷雾剂和粉雾剂市场容量为122亿元,近5年复合增长率(GAGR)高达16.38%。
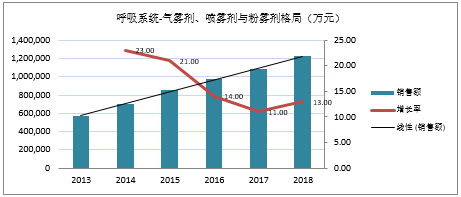
在剂型细分领域,IQVIA分析报告显示,全球各剂型处方量中气雾剂占55%,粉雾剂占35%,雾化溶液占10%;销售金额中,气雾剂占32%,粉雾剂占46%,雾化溶液占22%,可见全球气雾剂的销售量最大,而粉雾剂的销售金额最大,主要原因为气雾、粉雾剂型的市场先发优势。
中国市场呈现不同的情况,统计中国城市公立医院数据发现,2018年呼吸系统用药之气雾剂、喷雾剂与粉雾剂产品名称TOP20格局(下表所示)中,雾化溶液占62%的市场,粉雾剂占25%,气雾剂只占2%不到,说明中国吸入制剂市场有其内在的特点,其中雾化吸入溶液代表产品在国内均呈增长趋势。
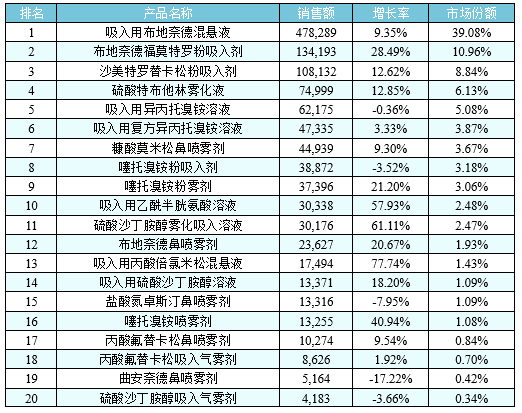
原研产品占有垄断地位
目前在中国及欧美上市治疗哮喘和慢性阻塞性肺病的药物类别主要有:长/短效β2受体激动剂药物 、长/短效抗胆碱能药物、糖皮质激素、白三烯受体拮抗剂、细胞因子抑制剂等。
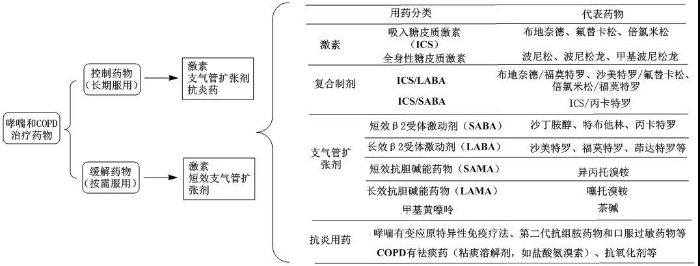
目前国内吸入制剂研发热度较高品种:
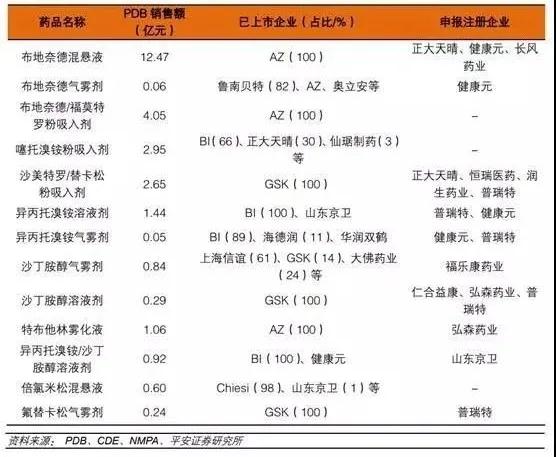
从以上数据可知,目前布地奈德混悬液、布地奈德福莫特罗粉吸入剂、沙美特罗替卡松粉吸入剂等重磅品种,国内仅原研获批,市场份额完全被原研企业占据。国内企业正在积极布局,一旦首仿成功,有望快速实现进口替代。从已上市和研发布局情况来看,正大天晴、健康元、恒瑞医药、长风药业、普瑞特、山东京卫、仙琚制药等处于领先位置。
相关法规要求
在现代吸入制剂近70年的发展历史中,欧美日等医药市场发达的国家相继制定了近20个相关的指导原则及指南,最早一部指南应追溯到1991年10月11日美国联邦登记处公布的<56 FR 51354>指南:Guidance for Industry Sterility Requirement for Aqueous-Based Drug Products for Oral Inhalation -Small Entity Compliance Guide(以水为基质的口服吸入药物产品工业无菌要求-小体积合规指南),明确规定所有处方和非处方水性药物产品用于口服吸入都是无菌的。
2007年,在参考国内外相关指导原则和文献的基础上,中国药监部门通过分析质量控制研究与安全有效性和质量可控性之间的内在关系,制定了《吸入制剂质量控制研究技术指导原则》,旨在为药物研发者在吸入制剂质量控制研究过程提供基本的技术指导。
随后在2015版《中国药典》四部中增加了吸入制剂剂型,详细描述了其药学研究阶段从原料药控制到雾化特性研究相关的检测指标和检测方法,并明确“递送速率”“递送总量”“微细粒子剂量”及“无菌”等检测项应列入质量标准。
2019年8月2日,CDE 发布《经口吸入制剂仿制药药学和人体生物等效性研究指导原则(征求意见稿)》,旨在针对经口吸入制剂仿制药的药学和人体生物等效性研究等方面提供技术指导,提出仿制药品在开发阶段药学和人体生物等效性研究的方法,为国内吸入制剂药物研发指明方向。
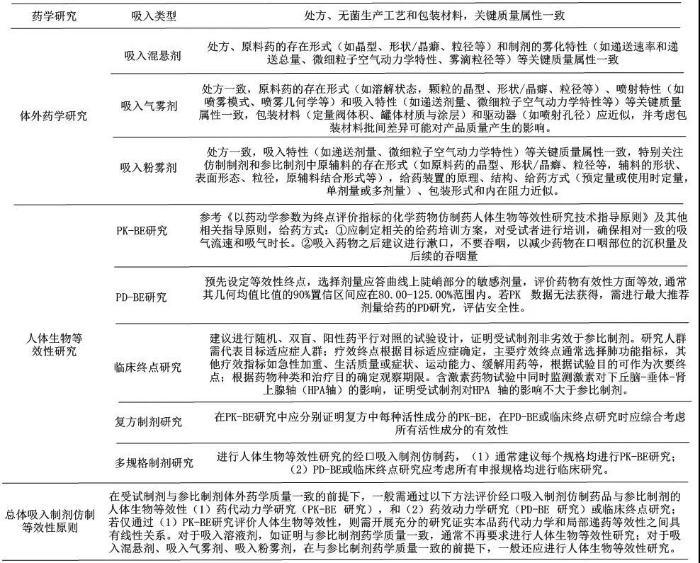
纵观各国关于吸入制剂指导原则及指南要求,全球已基本达成共识,主要涉及无菌保障、雾化特性质量研究和生物等效性研究三个方面,汇总如下:
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













