每周医药看点(6.29~7.5)
- 2020-07-06 08:08
- 作者:李硕
- 来源:中国食品药品网
中国食品药品网讯 2020年版《中国药典》发布,药品注册实行新的收费标准,甘李药业在上交所主板挂牌……6月29日~7月5日,医药行业需要关注这些大事。
行业政策动态
1.国家药监局、国家卫生健康委发布2020年版《中华人民共和国药典》,共收载品种5911种,其中,新增319种,修订3177种,不再收载10种,品种调整合并4种,自2020年12月30日起实施。
2.国家药监局发布化学药品、生物制品注册分类及申报资料要求等系列药品、医疗器械相关文件。具体如下:
药品相关:
其中,关于生物制品注册分类,自2020年7月1日起实施,关于生物制品申报资料要求,自2020年10月1日起实施。
其中,关于化学药品注册分类,自2020年7月1日起实施,关于化学药品注册申报资料要求,自2020年10月1日起实施。
自2020年7月1日起施行。 对于2020年7月1日前受理的药品注册申请,自7月1日起15个工作日内未按要求缴费的,终止药品注册程序。在新冠肺炎疫情防控期间,对进入药品特别审批程序、治疗和预防新型冠状病毒感染肺炎的药品,免征药品注册费。
自2020年12月1日起施行。
(5)《药品生产质量管理规范(2010年修订)》血液制品附录修订稿
作为《药品生产质量管理规范(2010年修订)》配套文件发布,自2020年10月1日起施行。
医疗器械相关:
3.国家药监局器审中心就《体外诊断试剂许可事项变更技术审查指导原则(第二版征求意见稿)》《柠檬酸消毒液注册申报技术审查指导原则(征求意见稿)》公开征求意见。
4.国家药监局器审中心启动《遗传性耳聋相关基因检测试剂技术审查指导原则》《接受体外诊断试剂境外临床试验数据的操作指南》《隐球菌抗原检测试剂注册技术指导原则》等文件的编制工作,面向境内、外征集相关生产企业信息。
5.国家药监局药审中心(CDE)发布《研发期间安全性更新报告管理规范(试行)》《药物临床试验期间安全信息评估与管理规范(试行)》《化学药品注册受理审查指南(试行)》《生物制品注册受理审查指南(试行)》以及《M4模块—行政文件和药品信息》等文件,并就《化学仿制药参比制剂目录(第三十批)》《药审中心补充资料管理规范(征求意见稿)》公开征求意见。
6.广东、山东、安徽等地发布通知,决定开展医保定点医疗机构专项治理工作,治理医保定点医疗机构违规违纪违法使用医保基金的行为。
产品研发/上市
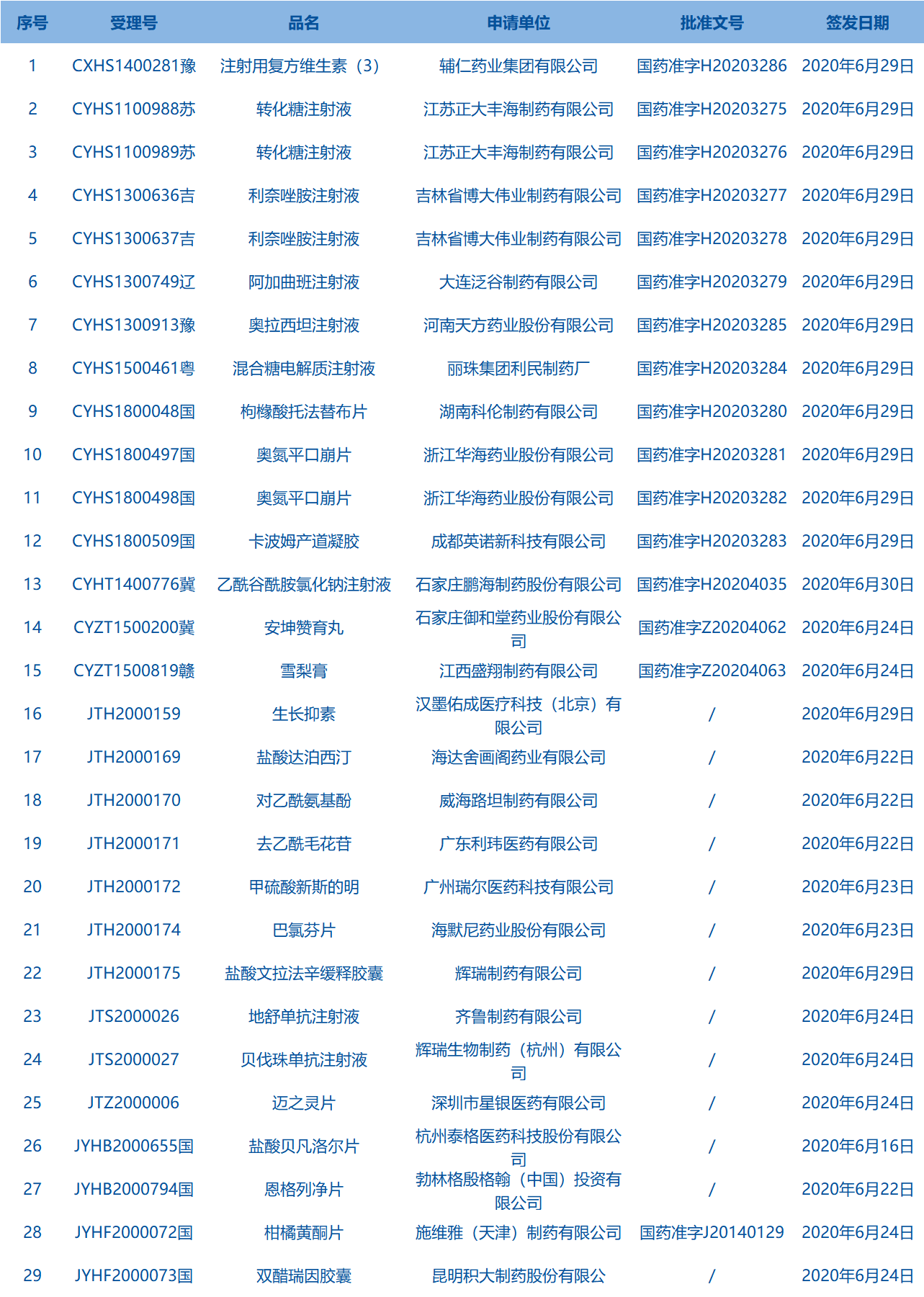
1.国家药监局发布2期药品批准证明文件待领信息,共包括29个受理号,涉及浙江华海药业股份有限公司等企业。
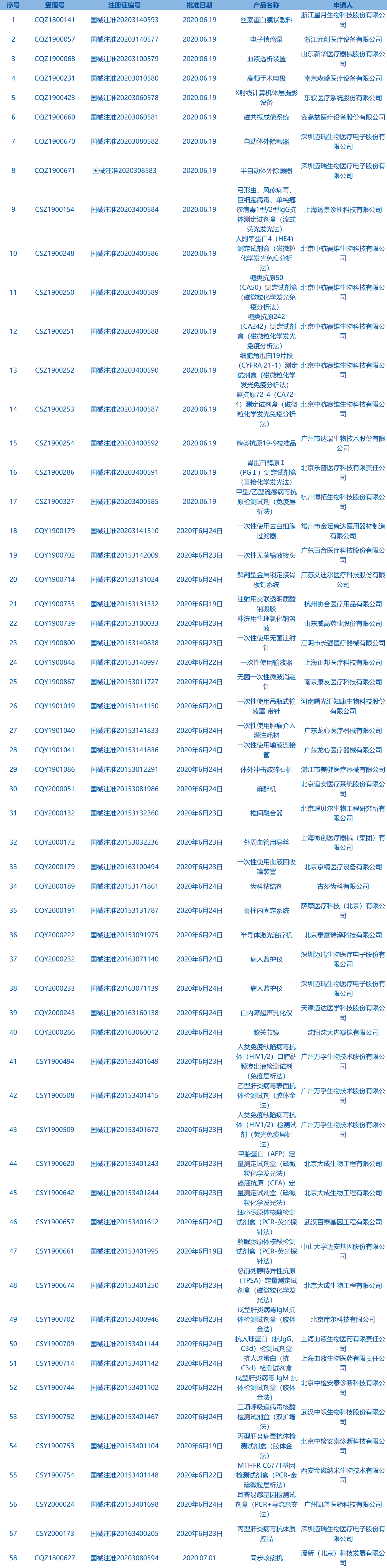
2.国家药监局发布3期医疗器械批准证明文件(准产)待领信息,共包括58个受理号,涉及上海正邦医疗科技有限公司等企业。
3.CDE网站公示50个仿制药一致性评价任务,涉及碘海醇注射液等药品。

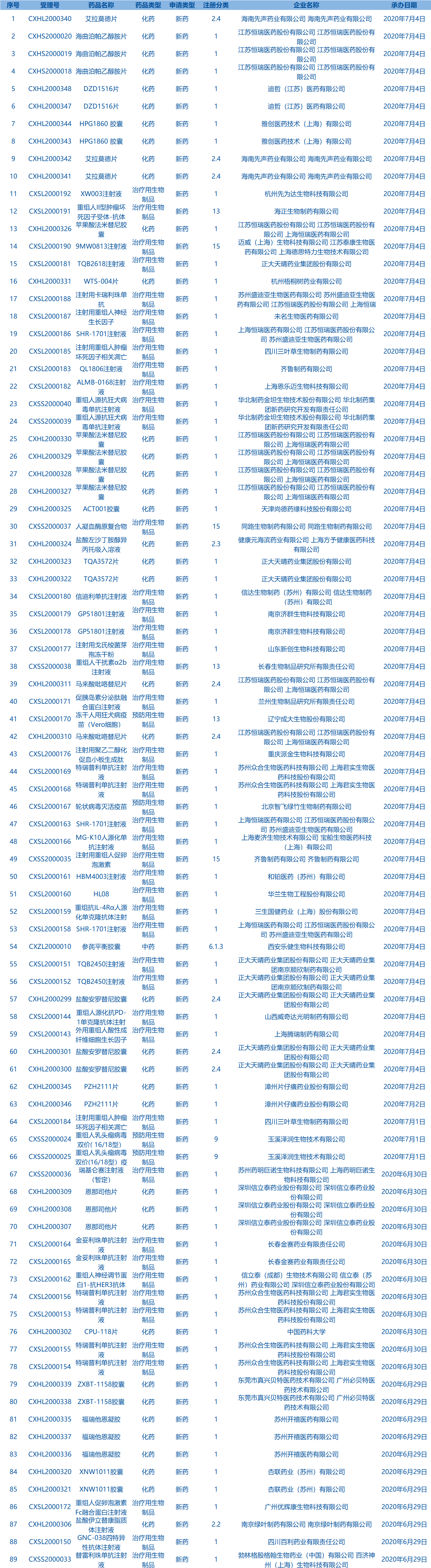
4.CDE承办受理89个新药上市申请,包括苹果酸法米替尼胶囊等药品。
5.国家药监局器审中心发布医疗器械优先审批申请审核结果,杭州依图医疗技术有限公司申请的儿童骨龄智能辅助诊断软件拟定予以优先审批。
医药企业观察
1.上海君实生物、江苏艾迪药业分别发布公告称,两家公司首次公开发行A 股并在科创板上市的申请已经上海证券交易所科创板股票上市委员会委员审议通过,并已经中国证券监督管理委员会同意注册。
2.京东健康与西门子医疗通过线上签约仪式签署合作协议,双方将在医疗器械及大型医疗设备领域,基于各自的能力和资源,提升非公医疗机构服务能力。
3.甘李药业在上海证券交易所主板正式挂牌上市,本次公开发行的股票规模为4020万股,发行价格为63.32元/股,募集资金25亿元。
4.康基医疗正式在港交所挂牌上市,本次上市发行定价为13.88港元/股,总计发行2.25亿股。
5.头部医药零售连锁企业一心堂设立一心堂医养服务股份公司并取得营业执照。
6.索元生物宣布完成5.9亿元规模的C轮融资。
7.东软医疗向上交所提交了科创板IPO招股书。本次募集的资金将主要用于核心产品、技术部件的研发,以及营销网络、品牌与培训体系的建设等。
8.博泌生物宣布与武田制药签署一项研究合作协议,利用博泌生物的REGENT?技术(基于红细胞外囊泡)发现、开发和商业推广治疗两种罕见病的变革性非病毒基因疗法。
9.Citryll宣布完成共1850万欧元融资,所得资金将用于推进CIT-013治疗性抗体的临床前和临床开发,该抗体是中性粒细胞胞外陷阱(NETs)及其形成(NETosis)的抑制剂。
药品集中采购
1.北京市医保局发布通知,要求各医疗机构对第三批国家集采品种进行报量,报送数据为第三批国家集采品种预采购量,即本医疗机构下一国家药品集中采购周期内(按一年计算),与第三批国家集采品种同通用名、剂型、规格所有厂牌药品的总需求量,以单支单片计。
2.浙江省发布《浙江省提升药品集中采购平台功能推进医保药品支付标准全覆盖改革方案》,并于9月1日起正式施行。方案明确,与已在线交易同通用名、同剂型产品(不包括低价药品、供应紧张药品、原廉价药品、普通大输液、带量采购涉及通用名的药品),可按以下定价原则申请挂网:不高于同剂型产品最低价的70%和原研药品的49%的低值,且不高于其全国最低价。其中,与在线交易产品已共同被认定为原研药品的,不高于已在线交易原研药品的70%。此外,建立市场化退出机制,通过开展带量采购、实行小单元同品规竞价、制定同通用名单一医保支付标准等多种方式予以退出。
3.安徽省医保局等四部门联合发布了《推广高值医用耗材集中带量采购试点经验实施办法》,明确在全省范围内全面推广高值医用耗材集中带量采购试点经验,进一步扩大实施范围和采购类别,该实施办法自2020年7月1日施行。
4.云南省医保局发布该省超国家医保药品目录范围药品消化调整方案。自6月30日24时起,同步对2019版国家药品目录调出的药品、超出国家医保支付剂型的药品、复合药、国家明确不予支付的中药饮片、国家重点监控药品停止医保报销。
5.西藏自治区医保局发布《关于报送第三批国家组织药品集中采购品种范围相关采购数据的通知》,部署安排第三批国家组织药品集中采购数据填报工作。(中国食品药品网综合整理/李硕)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
相关阅读
- 每周医药看点(6.29~7.5)
-
为你推荐













