8月授权交易热度持续,看看君实、百济等引进了哪些创新疗法
- 2020-09-04 09:52
- 作者:
- 来源:中国食品药品网
炎炎8月,中国医药行业的授权交易合作热度不减。据不完全统计,至少有12起授权合作在8月达成,涉及创新产品有双特异性抗体、三特异性抗体、新一代溶瘤病毒及多种小分子抑制剂等。在君实生物、百济神州、礼来(Eli Lilly and Company)、先声药业、开拓药业等多家公司引进产品的同时,亦诺微医药、信达生物、百奥泰生物等公司也实现将旗下产品授权出去。本文节选部分备受关注的授权案例,看看这些交易都涉及哪些创新疗法和技术。
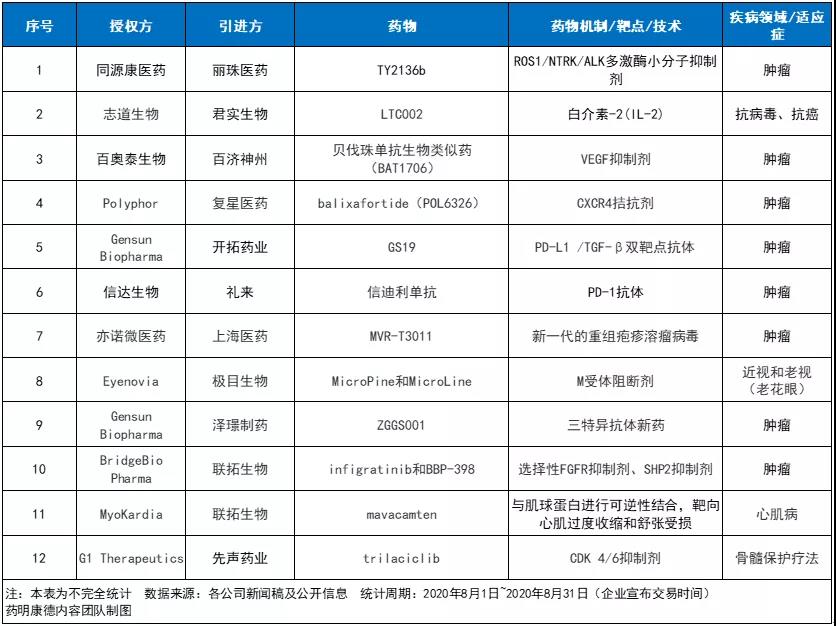
1、引进方:丽珠医药
授权方:同源康医药
作用机制/靶点:ROS1/NTRK/ALK多激酶小分子抑制剂
丽珠医药获得同源康医药自主研发的TY2136b项目及其相关专利在中国(包括台湾地区)的独家开发及商业化权利。TY-2136b是一款处于临床前阶段的新一代ROS1/NTRK/ALK多靶点小广谱酪氨酸激酶抑制剂(TKI)。ROS1、NTRK和ALK基因异常均与肿瘤的发生或发展有关,尤其是非小细胞肺癌。
2、引进方:君实生物
授权方:志道生物
作用机制/靶点:白介素-2(IL-2)
君实生物将获得志道生物授权在全球范围内对IL-2药物进行临床前开发、临床研究及商业化并使用相关专利技术的独占许可,目前该项目处于临床前开发阶段。白介素-2(IL-2)是一种在维持T淋巴细胞和NK细胞的正常功能中起着重要作用的球状糖蛋白。
根据公告,志道生物采取了一种独特创新的方式消除与IL2Rα受体的结合,利用在IL-2内部引入额外的二硫键,其不仅可以使得IL-2从结构上更加稳定,而且还可以形成屏障,使IL-2分子以最小的改变达到破坏与α受体的结合平面。突变分子无法与体内的内源性α受体结合,但是可以与β和γ受体亚基结合。因此降低或消除IL-2与α受体亚基的相互作用,可能是治疗有效性并减少肿瘤患者治疗副作用的一个重要方面。
3、引进方:百济神州
授权方:百奥泰生物
作用机制/靶点:VEGF抑制剂
百奥泰生物同意授权百济神州在中国(包括台湾地区)对BAT1706进行开发、生产及商业化。BAT1706是一款由百奥泰生物开发的贝伐珠单抗生物类似药,其通过与血管内皮生长因子(VEGF)结合而起效。BAT1706在中国有望成为一项用于治疗包括结直肠癌、肺癌和肝癌在内的多项实体瘤适应症的重要治疗选项。
值得一提的是,该在研药物在中国的上市申请已于近期获得国家药监局受理。据悉,百奥泰计划将于2020年第四季度在美国和欧盟递交BAT1706的相关上市许可申请。
4、引进方:复星医药
授权方:Polyphor
作用机制/靶点:CXCR4拮抗剂
复星医药控股子公司Fosun Pharmaceutical AG已经获得Polyphor 公司许可,在中国(包括台湾地区)使用其专利专有技术及改进独家临床开发、商业化(不包括制造)一款CXCR4拮抗剂balixafortide(POL6326)及其相关产品组合。balixafortide早前已经获得美国FDA授予的快速通道资格。
根据公告,balixafortide是一款由Polyphor公司(基于由苏黎世大学授权的专利)研发的CXCR4拮抗剂。目前,该产品已于美国等地区完成联用甲磺酸艾立布林注射液针对HER2阴性转移性乳腺癌的1b期临床研究,并正在开展联用甲磺酸艾立布林注射液治疗HER2阴性转移性乳腺癌的全球多中心3期临床研究。
5、引进方:开拓药业
授权方:Gensun Biopharma
作用机制/靶点:PD-L1 /TGF-β双靶点抗体
开拓药业将获得Gensun公司的PD-L1 /TGF-β双靶点抗体GS19在大中华区的独家临床开发及商业化授权。据悉,开拓药业将加速临床前研发尽快完成IND注册申请和临床开发,同时积极探索联合ALK-1抗体治疗晚期癌症的临床策略。
GS19是一款针对PD-L1和TGF-βR2的双靶点抗体,具有同时抑制PD-L1和TGF-βR2的高度活性,Gensun公司拥有该药的全球知识产权。经过基因工程修饰能够降低该在研药在CHO细胞表达蛋白中的降解或片段化,更易于商业化生产。
6、引进方:礼来
授权方:信达生物
作用机制/靶点:抗PD-1单克隆抗体
信达生物与礼来制药扩大关于免疫肿瘤药物抗PD-1单克隆抗体达伯舒(信迪利单抗)的战略合作,将授予礼来信迪利单抗在中国以外地区的独家许可,礼来将致力于将信迪利单抗推向北美、欧洲及其他地区。
信迪利单抗是信达生物制药和礼来制药在中国共同合作研发的创新生物药,已于2018年底在中国获批用于治疗复发/难治性经典型霍奇金淋巴瘤。同时,该产品用于非鳞状非小细胞肺癌(NSCLC)一线治疗、鳞状NSCLC患者一线治疗的两个新适应证申请也已分别获得国家药监局受理。此外,信达生物有超过20项临床研究(其中10多项是注册临床试验)正在进行中,以评估信迪利单抗在各类肿瘤上的有效性和安全性。
7、引进方:上海医药
授权方:亦诺微医药
作用机制/靶点:新一代重组疱疹溶瘤病毒
上海医药获得亦诺微医药溶瘤病毒MVR-T3011(T3011,瘤内注射)在大中华区的独家临床开发和商业化权益。亦诺微医药保留MVR-T3011在大中华地区以外区域的开发和商业化权益。目前,T3001已在中国、美国、澳大利亚三个国家开启临床试验。同时,它还在开展与多种抗肿瘤疗法联用的临床前研究,包括与免疫检查点抑制剂(Anti-PD-L1)、Anti-VEGF(Avastin)、凋亡抑制因子抑制剂(LCL-161)、放疗等。
T3011是亦诺微医药开发的新一代的重组疱疹溶瘤病毒,可直接经瘤内注射治疗,并可用于治疗局部晚期、复发或转移性实体瘤的抗肿瘤药物。该产品采用了亦诺微医药专有的病毒骨架,兼顾安全性的同时提高了病毒的复制力与抗肿瘤能力。T3011插入的细胞因子组合IL-12和Anti-PD-1抗体具有新颖性及临床合理性。
8、引进方:极目生物
授权方:Eyenovia
作用机制/靶点:M受体阻断剂
Arctic Vision(极目生物)与Eyenovia公司签订独家许可协议,以在大中华区及韩国开发及商业化Eyenovia两款主要眼科创新疗法MicroPine和MicroLine,分别用于治疗进展性近视和老视(又称:老花眼)。
其中,MicroPine(阿托品眼用溶液)用于治疗进展性近视,这是一种通常被称为近视的眼后节疾病。MicroPine的研发兼顾了儿童用药的舒适性和易用性,其微剂量给药旨在降低药物在全身和眼部的暴露水平。
MicroLine(匹罗卡品眼用溶液)是一种针对老视的药物治疗方法,由匹罗卡品与微矩阵药膜之间的结合形成。老视无法预防,由于眼内晶状体随年龄增长硬化而导致眼球逐渐失去聚焦于近处物体的能力。匹罗卡品眼用溶液其机制为通过小孔效应形成扩大的焦深。
9、引进方:泽璟制药
授权方:Gensun Biopharma
作用机制/靶点:三特异性抗体
泽璟制药与其控股子公司Gensun Biopharma签署《独家许可协议》,就三特异抗体新药ZGGS001进行合作开发并获得在大中华区的专利独家授权。ZGGS001是一种新颖的三特异性抗体分子,主要抑制肿瘤免疫和多条肿瘤血管生成途径、调节肿瘤微环境。
根据公告, ZGGS001能同时结合并抑制三个不同靶点,且无相互之间的活性及结合干扰。公告显示,作为一款全新蛋白质药物,GENSUN公司已经在作用机制、药学、临床前药效学方面,对ZGGS001开展了一定的研究,可为该项目后续开发提供技术基础。目前,该产品处于临床前开发阶段。
10、引进方:联拓生物
授权方:BridgeBio Pharma
作用机制/靶点:选择性FGFR抑制剂、SHP2抑制剂
联拓生物将获得BridgeBio Pharma研发的两款肿瘤产品中国及指定亚洲市场的商业化权益,包括现正进行3期临床试验的infigratinib,以及治疗因RAS和酪氨酸激酶受体导致的实体肿瘤的BBP-398,并参与两款产品临床研发。同时,联拓生物获得BridgeBio公司超过20种管线产品在中国及其他亚洲主要市场的优先使用权。
抗肿瘤候选药infigratinib是一款首创的选择性FGFR抑制剂,目前正处于3期开发阶段,用于治疗由FGFR基因异常导致的胆管癌(CCA)和尿路上皮癌(膀胱癌)等疾病。作为QED PROOF全球3期临床研究的一部分,联拓生物正在我国开展将infigratinib用于一线胆管癌治疗的研究,并进一步计划启动将infigratinib用于胃癌以及其他因FGFR基因变异导致的肿瘤疾病的2a期临床研究。
另一款抗肿瘤产品BBP-398,是一种新型SHP2抑制剂,主要用于治疗耐药性肿瘤和其他难治性肿瘤。在中国大陆和亚洲其他主要市场,联拓生物将在各种实体肿瘤(如非小型细胞癌、结肠直肠癌和胰腺癌)中研究BBP-398与其他药物组合的联合疗法。
11、引进方:联拓生物
授权方:MyoKardia
作用机制/靶点:与肌球蛋白进行可逆性结合,靶向心肌过度收缩和舒张受损
联拓生物与MyoKardia公司达成战略合作,以在中国及其他亚洲地区开发和商业化创新心肌病靶向疗法mavacamten。这是一种首创的小分子治疗药物,曾获FDA授予的突破性疗法认定。目前,该产品正在开发用于肥厚型心肌病(HCM)以及目标射血分数保留(HFpEF)的心力衰竭患者。
该产品能够与肌球蛋白进行可逆性结合,直接靶向梗阻性和非梗阻性肥厚型心肌病引起的心肌过度收缩和舒张受损。MyoKardia公司计划于2021年第一季度在美国提交候选药的新药申请,并同时开发该药物对于治疗非梗阻性HCM患者及射血分数保留性心脏衰竭患者的研究。
12、引进方:先声药业
授权方:G1 Therapeutics
药物作用机制/靶点:CDK 4/6抑制剂
先声药业获得G1 Therapeutics公司独家许可引进CDK 4/6抑制剂trilaciclib在大中华区所有适应证的开发和商业化的权益。Trilaciclib是一款由G1公司发现并开发的全球首上市创新药,已于今年6月在美国提交新药申请,用于小细胞肺癌患者的骨髓保护,并作为I-Spy2试验的一部分开始了乳腺癌新辅助化疗的研究。G1公司预计在2020年第四季度在美国启动一项针对结直肠癌的3期注册性临床试验。
Trilaciclib在小细胞肺癌患者化疗前给予,根据在美国展开的三项随机、双盲、安慰剂对照临床试验的骨髓保护数据,获得了FDA突破性疗法认定。(药明康德内容团队)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐