《药品注册管理办法》学与践|中外生物制品分类及新药定义对比
- 2020-09-24 17:13
- 作者:佟路
- 来源:中国食品药品网
新修订《药品注册管理办法》已于今年7月1日正式施行。作为《药品注册管理办法》的重要执行文件之一,国家药品监督管理局于6月30日发布了《生物制品注册分类及申报资料要求》,生物制品注册分类也自7月1日起实施。
笔者在此对目前我国的生物制品注册分类要求进行总结,同时简要介绍美国生物制品分类和新药定义,以供业内参考。
我国现阶段生物制品注册分类
根据国家药品监督管理局6月30日发布的《生物制品注册分类及申报资料要求》,我国的生物制品注册分类按照预防用生物制品和治疗用生物制品分为以下类别:
一、预防用生物制品
预防用生物制品注册分类包括:创新型疫苗、改良型疫苗、境内或境外已上市的疫苗。具体分类如下表:



二、治疗用生物制品
与预防用生物制品相类似,治疗用生物制品注册分类包括:创新型生物制品、改良型生物制品,和境内或境外已上市生物制品,具体分类如下表:
综上所述,由于目前我国的新药定义已调整为“未在中国境内外上市销售的药品”,因此生物制品注册分类的划分除了考虑科学性外,还须结合在中国申报注册上市时该生物制品是否已在境外上市等因素。
美国生物制品分类
美国FDA对于生物制品并没有类似中国生物制品的注册分类,而是在公共健康服务法案(PHS)中,规定了生物制品、生物类似物的定义,并且对新的生物制品和生物类似物的基本要求加以区分。此外,FDA在相应的指导原则中也规定了针对新生物制品和生物类似物不同的技术要求。PHS中对于新生物制品和生物类似物的规定详见下图。

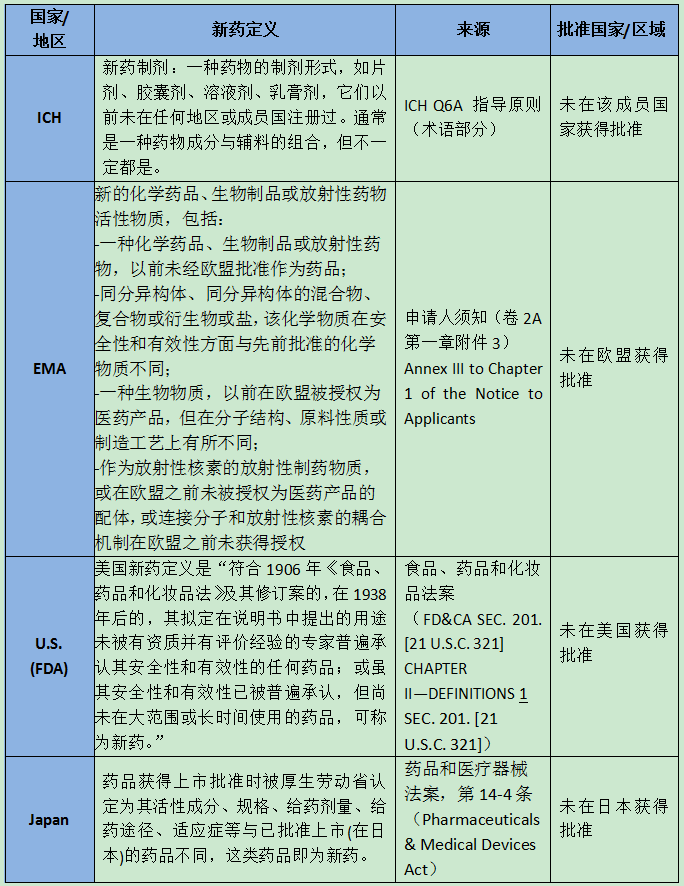
ICH及欧盟、美国、日本的新药定义
新药定义是药品/生物制品分类的基础,ICH及欧盟、美国、日本的新药定义如下:
(佟路)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐














