中美欧药品注册对照谈 | 浅析药物临床试验期间变更和上市后变更管理
- 2020-09-25 19:20
- 作者:汪旭 徐娜
- 来源:中国食品药品网
新《药品注册管理办法》(以下简称新《办法》)共有126条,其中涉及“变更/补充申请”相关内容的共20条。变更贯穿药品研发、生产、流通全生命周期,涉及药学、非临床、临床等各个方面,可能对药品的质量、安全性、有效性产生不同程度的影响,因此药品申请人/上市许可持有人应当对变更进行充分评估。
新《办法》中主要涉及的变更管理为药物临床试验期间变更和药品上市后变更。增加新适应证、改变给药途径等,根据规定需要按照新药临床试验和新药上市申请进行申报和审评审批,不在变更管理范畴。
新《办法》第四十条明确,“药品上市许可申请审评期间,发生可能影响药品安全性、有效性和质量可控性的重大变更的,申请人应当撤回原注册申请,补充研究后重新申报”。本文主要从药物临床试验期间变更管理和药品上市后变更管理两方面进行简要探讨。
临床试验期间变更
中国临床试验期间变更管理
长期以来,我国临床试验期间的变更在法规层面并没有明确递交路径和程序。2007版《药品注册管理办法》(以下简称原《办法》)未涉及此方面相关内容。2012年5月,CDE发布了《关于化学药IND申请药学研究数据提交事宜的通知》,提出对于重大变更应提交补充申请,对于较小变更则可以通过年报形式提交相关数据。2018年7月,国家药品监督管理局发布《关于调整药物临床试验审评审批程序的公告》,该公告首次明确规定“对于变更临床试验方案、重大药学变更、非临床研究重要安全性发现等可能增加受试者安全性风险的,申请人应按相关规定及时递交补充申请”,弥补了临床试验期间变更管理的空白。
此次新《办法》进一步完善了我国药物临床试验期间变更管理制度,明确了药物临床试验期间变更的程序和要求。第二十九条明确规定了两条路径,“药物临床试验期间,发生药物临床试验方案变更、非临床或者药学的变化或者有新发现的,申办者应当按照规定,参照相关技术指导原则,充分评估对受试者安全的影响。申办者评估认为不影响受试者安全的,可以直接实施并在研发期间安全性更新报告中报告。可能增加受试者安全性风险的,应当提出补充申请。”新《办法》规定了临床试验期间补充申请的审评时限为60个工作日,其涉及的配套文件《研发期间安全性更新报告管理规范(试行)》已经于2020年7月1日起施行。
FDA临床试验期间变更管理
根据FDA的临床试验管理理念及申请架构,临床试验阶段发生的任何变更,均更新在同一IND下。申请人以方案修订(Protocol Amendments)、信息修订(Information Amendments)、安全报告(Safety Reports)、年度报告(Annual Reports)这四种形式递交临床期间变更材料。
EMA临床试验期间变更管理
EMA在法规中纳入临床试验批准后实质性变更修订(Substantial Modification)原则,明确了实质性变更的定义,即临床试验获批后发生的“任何可能对受试者安全和获益或临床试验数据可靠稳定性产生实质性影响的变更”。
收到变更通告后,伦理委员会及国家药品监管机构通常会在35个日历日内作出回复,如伦理委员会支持且国家药品监管机构未提出反对意见,则申请人可自行实施变更。若为非实质性变更,EMA则未强制要求申请人向伦理委员会或国家监管机构提交变更通告,但需将非实质性变更记录纳入后续提交的文件中。
中美欧临床试验期间变更管理模式的对比及分析
对于药物临床试验期间变更,我国与欧美的政策规定相似,均需按照法定渠道提交药监部门。在申报形式上,我国对于重大变更要求递交补充申请,微小变更可以通过安全性更新报告递交,中等变更的递交形式仍在征求意见中;欧盟实施实质性变更通告制;美国则采用方案修订、信息修订、安全报告、年度报告等制度。在审评时限方面,对于重大变更,欧美审评时限一般需1个月左右即可对临床期间的变更进行实施;我国审批时限为3个月左右。
药品上市后变更管理
中国药品上市后变更管理
药品上市后变更按照其对药品安全性、有效性和质量可控性的风险和产生影响的程度进行分级。上市后变更管理是药品上市后监管非常重要的措施。
新《办法》主要提出了基于对产品质量影响的变更分级管理制度,即审批类、备案类和报告类变更,较原《办法》增加了报告类变更,更加强化上市许可持有人的责任。
新《办法》第十一条明确定义药品上市后变更,变更的范围为“原药品注册批准证明文件及其附件所载明的事项或者内容的”。变更包括注册性变更、工艺变更、说明书标签的变更,上市许可持有人参照技术指导原则,充分评估变更可能对药品安全性、有效性和质量可控性的影响。
新《办法》取消了原《办法》附件内容,而以新《办法》为框架,陆续发布配套指导原则,这体现了监管理念的改变。在这些指导原则中,将规定审批类、备案类、报告类变更的具体申报事项和相关技术要求。由于变更的评估责任主体为上市许可持有人,相关指导原则将直接影响到持有人对于变更类别、申报形式等的判断。
新《办法》规定“审批类变更的补充申请审评时限为六十日,补充申请合并申报事项的,审评时限为八十日,其中涉及临床试验研究数据审查、药品注册核查检验的审评时限为二百日”。对于备案类申请,新《办法》没有时限相关规定。
FDA药品上市后变更管理
FDA将药品上市后变更分为重大变更、中等变更和微小变更三类,同时要求申请人评价变更对产品的影响。对于重大变更,FDA要求申请人递交需批准的变更( Prior Approval Supplement,PAS),获得批准后才允许变更;中等变更则有两种类型,一种要求申请者在变更前至少30天向FDA递交补充申请(CBE-30);另一种为FDA收到补充申请后申请人可实施变更(CBE-0);对于微小变更,申请人则可以立即实施,并通过年报形式递交。
FDA对于PAS的审批时限是4个月,中等变更(CBE-30或CBE-0)的审批时限是6个月(若FDA不批准CBE-30或CBE-0,可要求停止销售生产变更的药品)。
FDA并未明确规定上市后变更的沟通交流机制,但是出台了很多关于上市后变更的指导原则以及相关的“Q&A”供业界参考。
EMA药品上市后变更管理
EMA将药品上市后变更分为IA类变更、IB类变更、II类变更及紧急安全性限制(Urgent Safety Restriction)四类。IA类为微小变更,申请人实施变更后通知监管机构,可分为立即通知(IAIN类)或12个月内通知(IA类);IB类也属于微小变更,为未包括在II类和IA类中的变更,需做评价,若提交30天内未收到反对意见,则该变更视为批准;II类为重大变更,需批准后实施,一般审批时间为60天(不同申请也可能为30天,如安全性相关变更;或90天,如增加适应证);紧急安全性限制是指申请人或监管机构对威胁公众健康的事件采取的即刻变更程序,紧急安全限制可以在发起后15天之内提交正式变更申请。
EMA上市后变更法规(Commission Regulation (EC) No. 1234/2008)第5条明确,当申请人无法根据法规和指导原则判断变更类型时,申请人可以向相应的药监机构提出请求,获得关于变更分类的建议。药政部门应当在收到请求后45日内将回复反馈给申请人。
中美欧药品上市后变更管理模式对比及分析
中美欧对药品上市后变更均是按照变更的程度和风险等级划分管理要求,即根据变更对产品质量、安全性和有效性可能产生的影响设定不同变更等级,并分别设立了相应的递交途径、审批时限和变更实施原则。
表1 中美欧上市后变更管理模式对比
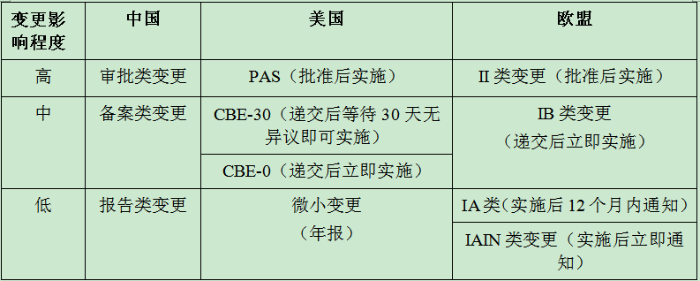
长期以来,我国的药品变更按照原《办法》附件4规定进行申报。然而,附件4所涉及的范围无法涵盖所有变更情况,且原《办法》也存在不尽合理的变更分类。
此次新《办法》的施行,涉及“药物临床试验期间变更”以及“ 药品上市后变更” 分级,给申请人或持有人提供了明确的变更注册路径和审评时限。
对于临床试验期间变更,我国借鉴了欧盟的临床试验期间变更指导原则,监管机构亦逐渐接受ICH理念,比如今年9月发布的《临床试验期间生物制品药学研究和变更技术指导原则》(上网征求意见稿)就体现了遵循研发规律,认可临床试验期间阶段性、渐进性特征。
在药品上市后变更方面,我国充分借鉴了欧美上市后变更指导原则,部分变更分类与原《办法》有了较大改变,比如,药品分包装由原《办法》需要审批改为备案,很大程度上简化了流程缩短了时限;再比如,审批类变更纳入“持有人转让药品上市许可”,这意味着持有人的变更被视作重大变更,持有人的资质将在药品上市许可转让过程中被重点考察,若同时涉及产地变更,根据《药品上市后变更管理办法(试行)(征求意见稿)》,可能需在持有人主体变更完成后才允许进行产地变更。
新《办法》增加了报告类的变更途径,企业可以年度报告的方式报告微小变更,无需审评审批,这较原《办法》提升了持有人实施变更的及时性和自由度。然而,持有人亦需关注并区分注册体系下的微小变更与药品生产GMP体系下的微小变更的差异性。(汪旭 徐娜 DIA中国药品法规事务社区核心成员)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













