每周医药看点(10.12~10.18)
- 2020-10-19 08:51
- 作者:李硕
- 来源:中国食品药品网
中国食品药品网讯 十三届全国人大常委会第二十二次会议表决通过了生物安全法,并决定对《中华人民共和国专利法》进行修改;注射用辅酶A说明书修订;盐酸埃克替尼片等8个药品进入拟优先审评审批程序……10月12日~10月18日,医药行业的这些事情值得关注。
行业政策动态
1.十三届全国人大常委会第二十二次会议表决通过了生物安全法,共计十章八十八条,自2021年4月15日起施行。生物安全法完善了生物安全风险防控基本制度。规定建立生物安全风险监测预警制度、风险调查评估制度、信息共享制度、信息发布制度、名录和清单制度、标准制度、生物安全审查制度、应急制度、调查溯源制度、国家准入制度和境外重大生物安全事件应对制度等11项基本制度,全链条构建生物安全风险防控的“四梁八柱”。
2.十三届全国人大常委会第二十二次会议决定对《中华人民共和国专利法》进行修改,增加一条,作为第七十六条:“药品上市审评审批过程中,药品上市许可申请人与有关专利权人或者利害关系人,因申请注册的药品相关的专利权产生纠纷的,相关当事人可以向人民法院起诉,请求就申请注册的药品相关技术方案是否落入他人药品专利权保护范围作出判决。国务院药品监督管理部门在规定的期限内,可以根据人民法院生效裁判作出是否暂停批准相关药品上市的决定。
“药品上市许可申请人与有关专利权人或者利害关系人也可以就申请注册的药品相关的专利权纠纷,向国务院专利行政部门请求行政裁决。
“国务院药品监督管理部门会同国务院专利行政部门制定药品上市许可审批与药品上市许可申请阶段专利权纠纷解决的具体衔接办法,报国务院同意后实施。”
3.国家药监局发布《关于做好重点品种信息化追溯体系建设工作的公告》,明确于2020年12月31日之前,基本实现国家药品集中采购中选品种、麻醉药品、精神药品、血液制品等重点品种可追溯。
4.国家药监局发布公告,决定对注射用辅酶A说明书警示语、【不良反应】、【注意事项】及特殊人群用药项进行修订。
5.国家医保局发布《关于2020年国家医保药品目录调整形式审查结果查询的公告》,相关申报企业可登陆“2020年国家医保药品目录调整申报系统”查询申报药品的形式审查结果。
6.国家卫生健康委公开征求《病原微生物实验室生物安全管理条例》修订建议。
7.国家卫生健康委发布《公民防疫行为准则》(科普版),共三部分73类,第一部分为公民防疫基本行为准则,第二部分和第三部分针对重点场所、重点人群主动防疫的关键风险点,对不同场景、不同人群提出健康防护准则。
8.国家药监局发布关于履行《关于汞的水俣公约》有关事项的通知,明确自2026年1月1日起,全面禁止生产含汞体温计和含汞血压计产品。
9.国家药监局综合司就《国家医疗器械质量抽查检验工作程序(征求意见稿)》《疫苗责任强制保险管理办法(征求意见稿)》和《药品召回管理办法(征求意见稿)》公开征求意见。
10.国家药监局药审中心(CDE)发布《境外已上市境内未上市药品临床技术要求》《放射性体内诊断药物临床评价技术指导原则》《中药新药用药材质量控制研究技术指导原则(试行)》《中药新药用饮片炮制研究技术指导原则(试行)》《中药新药质量标准研究技术指导原则(试行)》《急性细菌性皮肤及皮肤结构感染抗菌药物临床试验技术指导原则》和《社区获得性细菌性肺炎抗菌药物临床试验技术指导原则》等文件,并就《治疗绝经后骨质疏松症创新药临床试验技术指导原则(征求意见稿)》公开征求意见。
11.国家药监局器审中心就《血管内导管同品种对比临床评价技术审查指导原则(征求意见稿)》公开征求意见。
产品研发/上市信息
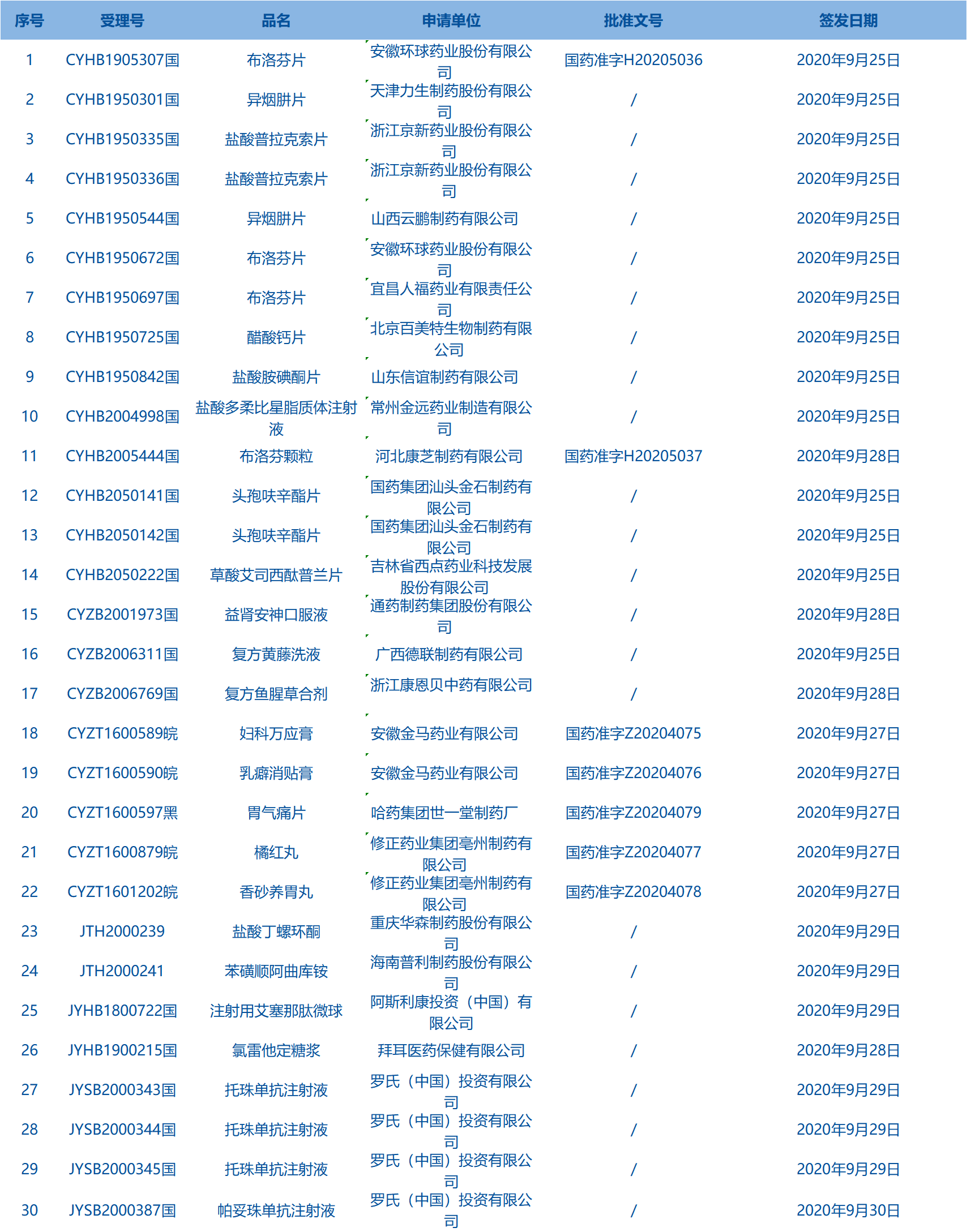
1.国家药监局发布1期药品批准证明文件待领信息,共包括30个受理号,涉及天津力生制药股份有限公司等企业。(截至10月18日)
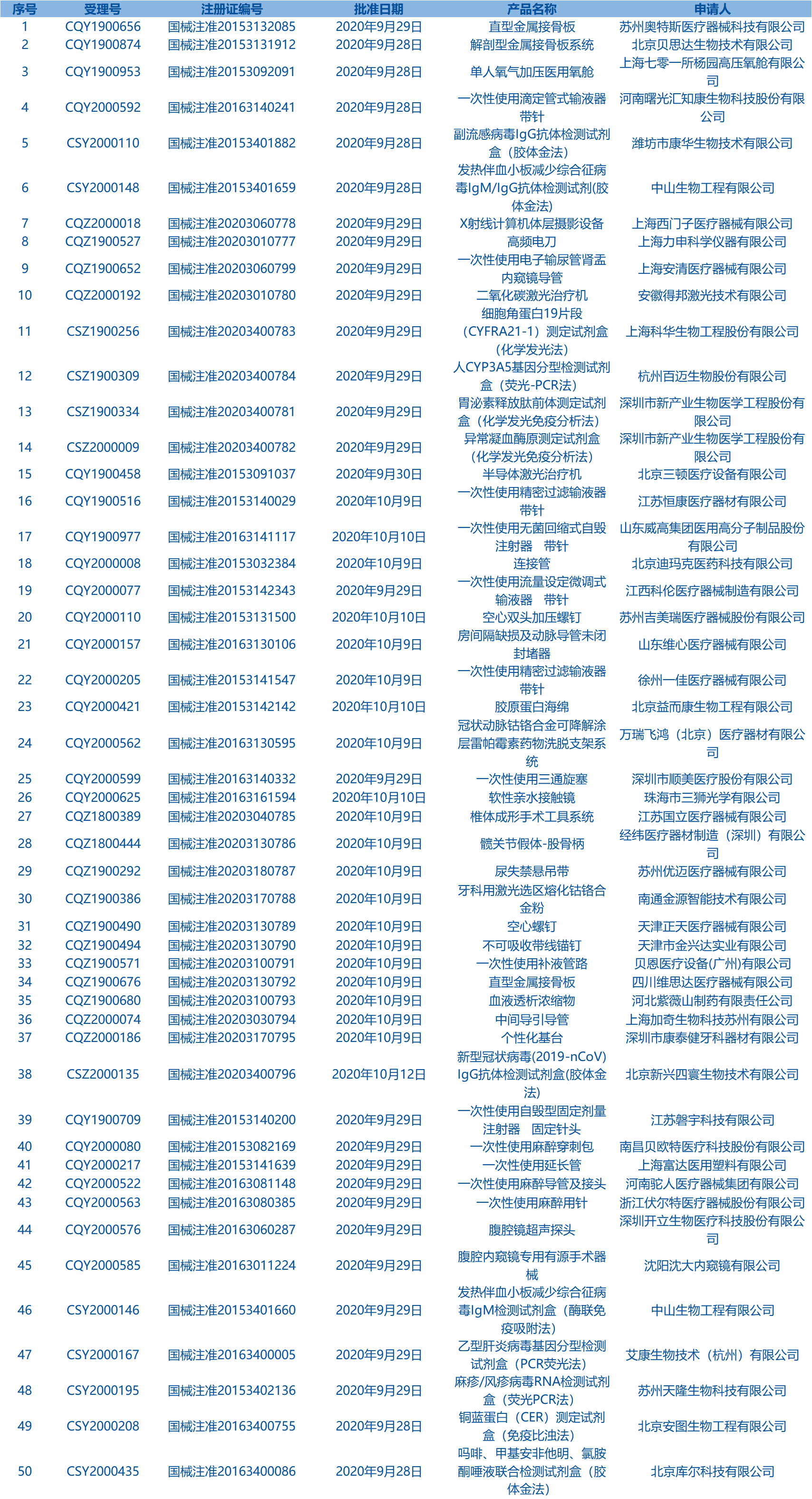
2.国家药监局发布5期医疗器械批准证明文件(准产)待领信息,共包括50个受理号,涉及苏州奥特斯医疗器械科技有限公司等企业。(截至10月18日)
3.国家药监局发布2020年9月进口第一类医疗器械产品备案信息,共170条。2020年9月进口第一类医疗器械产品备案信息.xls
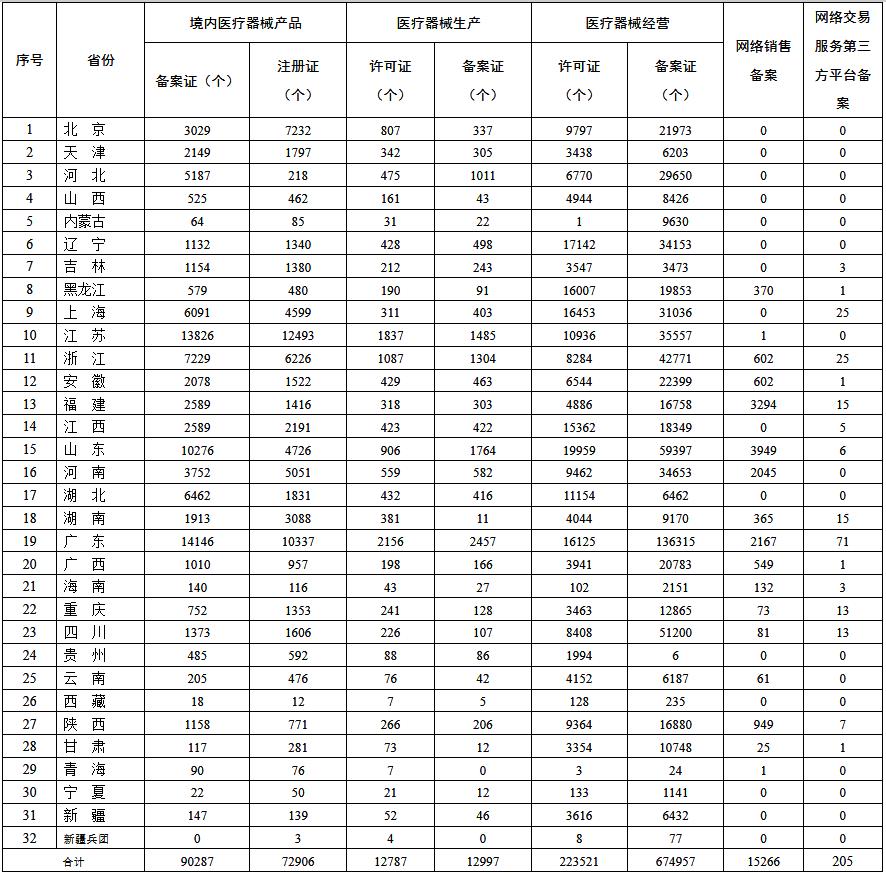
4.国家药监局汇总各省(市、自治区)有效期内医疗器械产品注册备案、医疗器械生产企业许可备案、医疗器械经营企业许可备案、医疗器械网络销售备案、医疗器械网络交易服务第三方平台备案信息,并按月发布,以满足企业公众查询医疗器械监管信息的需要。以下是截至9月30日的数据。
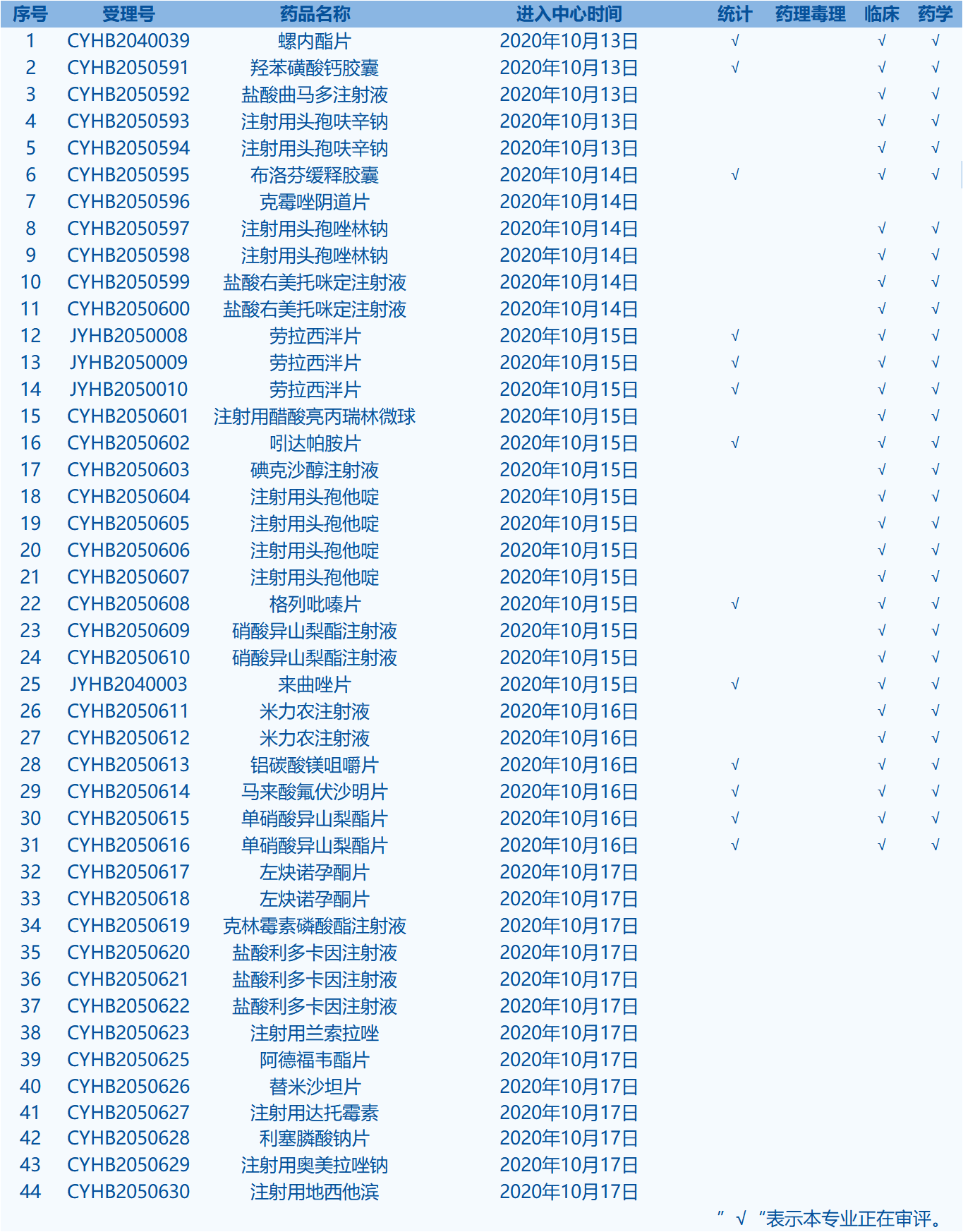
5.CDE网站公示44个仿制药一致性评价任务,涉及布洛芬缓释胶囊等药品。(截至10月18日)
6.CDE承办受理12个新药上市申请,包括健腰密骨片等药品。(截至10月18日)
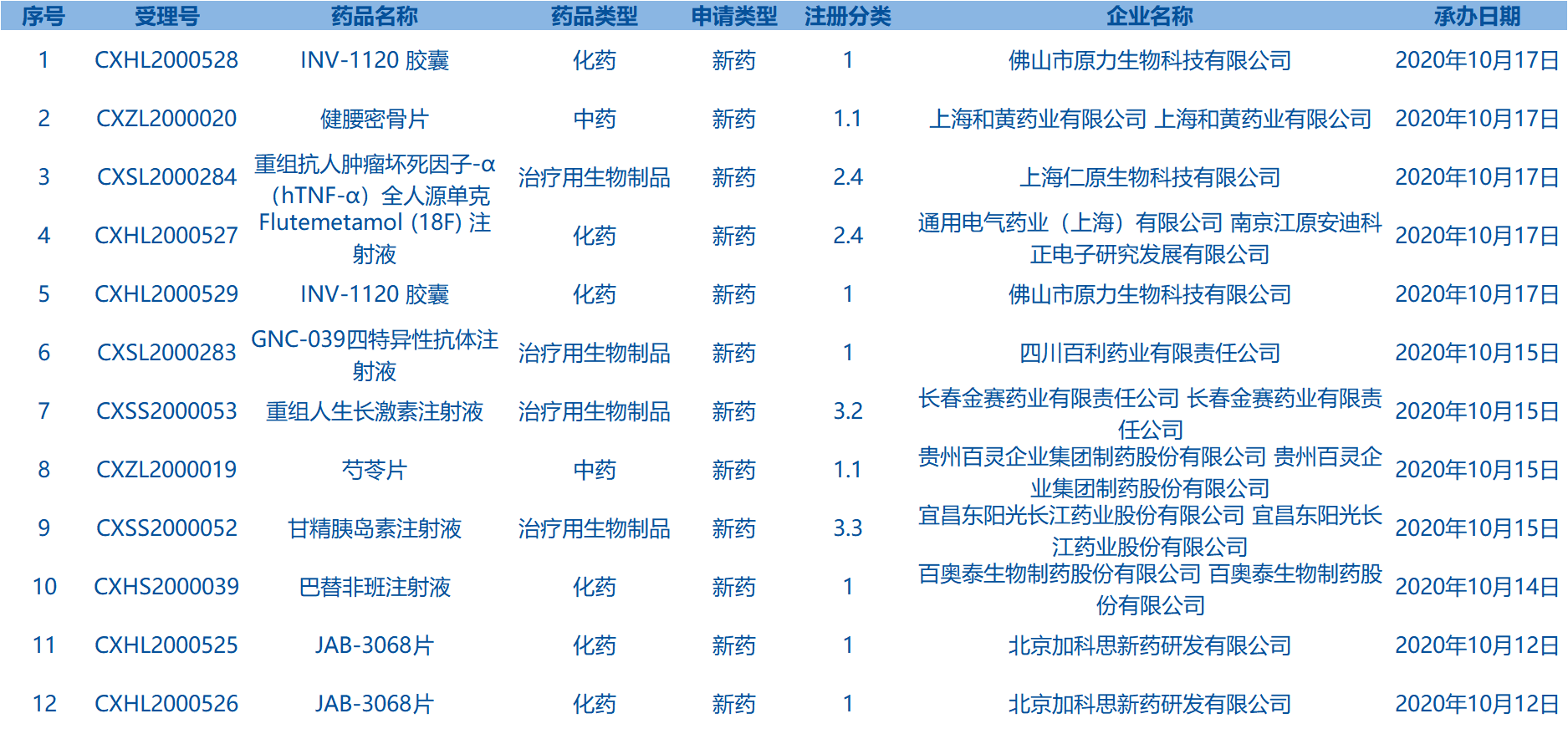
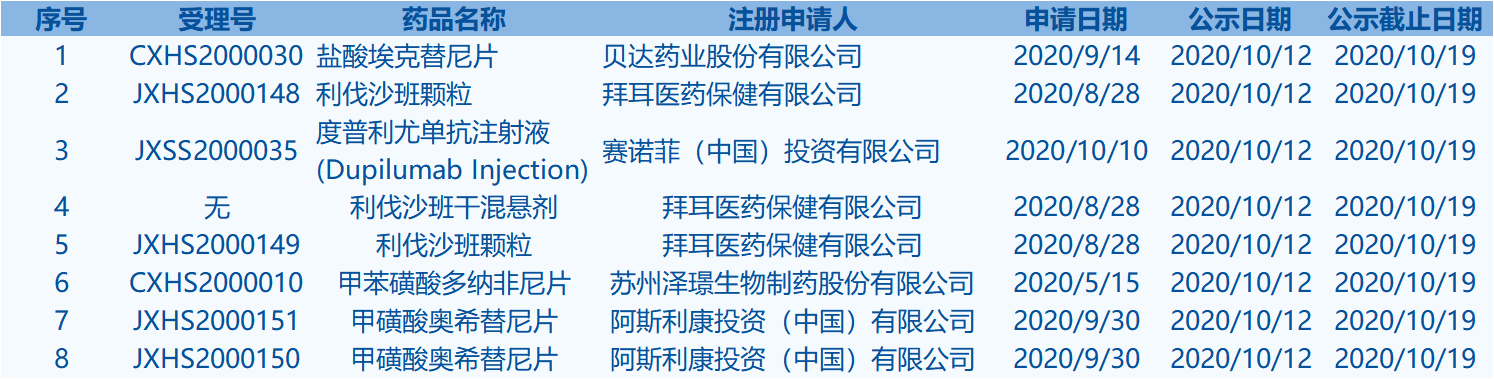
7.CDE网站信息显示,盐酸埃克替尼片等8个药品进入拟优先审评审批程序。
8.国家药监局食品药品审核查验中心发布的药品注册联合核查工作进展情况显示,截至今年9月底,该中心共与26个省级药品监督管理局开展了药品注册联合核查工作,累计启动827个品种的药品注册核查任务,目前有485个已完成并送达CDE。
医药企业观察
1.三诺生物传感股份有限公司发布公告称,其全资子公司三诺健康管理有限公司(以下简称三诺健康)拟作为意向投资者以自有资金不超过15000万元人民币参与增资上海医药大健康云商股份有限公司(以下简称上药云健康)项目。如本次增资完成,三诺健康将持有上药云健康4.95%股权,三诺健康将加强与上药云健康的业务合作,把产品和服务延伸至更多的用于糖尿病患者慢病管理的产品和服务。
2.北京昭衍新药研究中心股份有限公司发布公告,该公司拟发行境外上市外资股(H 股)并在香港联交所主板挂牌上市的申请材料已获中国证监会受理。
3.维康药业发布公告称,该公司拟与自然人陈荣鹅、潘志坦共同投资设立控股子公司“浙江维康印务有限公司”(暂定)。其中,维康药业认缴出资额为1400万元,占注册资本的70%。
4.前沿生物首次公开发行不超过8996万股人民币普通股(A 股)并在科创板上市的申请已经上海证券交易所科创板股票上市委员会委员审议通过,并已经中国证监会同意注册。
5.以岭药业与顺腾国际(控股)有限公司签订《谅解备忘录》,双方就国际品牌及销售合作、医疗合作等内容达成初步合作意向。
6.济川药业拟使用非公开发行股票募集资金(募集资金净额138372031.38元)向全资子公司济川药业集团有限公司、济川(上海)医学科技有限公司及陕西东科制药有限责任公司进行增资。拟以1151772031.38元对济川有限进行增资,拟以本次非公开发行募集资金净额中165000000元对济川医学增资,拟以本次非公开发行募集资金净额中67000000元对东科制药增资,用于募投项目建设。
7.华东医药发布公告称,其全资子公司Sinclair公司与瑞士医美研发机构Kylane公司达成股权投资和产品合作开发协议。根据协议,Sinclair公司出资600万欧元从Kylane公司现有股东处受让所有普通股,股权受让完成后Sinclair公司持有 Kylane公司20%股权;Sinclair公司将有权以约定对价获得Kylane公司在面部和身体填充剂领域两款重点研发产品的IP(知识产权)及其全球权益。
药品集中采购
1.重庆市、贵州省、云南省、湖南省、广西壮族自治区联合采购地区委派代表组成联合采购工作办公室,代表5省(市、区)医疗机构实施联合带量采购,拟定了第一批常用药品联合带量采购文件的征求意见稿,并公开征求意见。
附件:重庆市 贵州省 云南省 湖南省 广西壮族自治区第一批常用药品联合带量采购文件(征求意见稿).pdf
2.青海省医保局发布通知,明确自2020年11月1日起,全省所有参加集中采购的医药机构全面执行第三批国家组织和2020年省级组织药品集中采购中选结果。药品范围为国家联合采购办公室公布的《全国第三批药品集中采购中选品种表》中供应青海省的55个中选品种以及2020年省级组织药品集中采购46个中选品种(140个品规)。
3.湖南省医保局发布《关于加强对参与国家集采的医保协议零售药店管理的通知》,明确从2020年10月20日起,医保协议零售药店参与国家集采的,允许其在中选价格基础上按不超过15%加价销售。同时,要求重点将特殊门诊协议药店纳入国家集采范围。(中国食品药品网综合整理/李硕)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐













