2019年美国新药研发大盘点
- 2020-12-02 16:21
- 作者:
- 来源:艾昆纬
随着基础科学的突飞猛进,转化科学和临床研发的发展,近几年新药问世频破纪录。运用人类生命数据科学,可以进一步提高临床研发效率,缩短研发时长,提高研发成功率。本文对2019年美国新药上市情况进行盘点,以洞察创新趋势,展望发展前景。
新产品上市
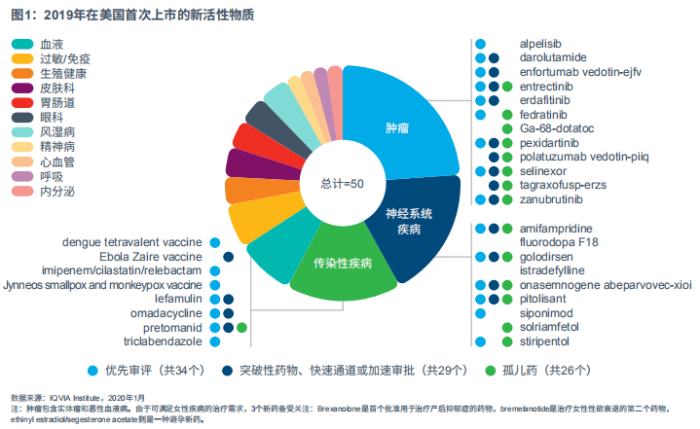
2019年上市的创新疗法数量超过历史平均水平。2009~2019年,美国平均每年上市40种新活性物质(NAS),2019年有50种NAS上市,与2018年的59种相比略有下降。NAS包括所有以前没有上市的新型小分子、生物制剂或新一代生物疗法(即细胞、基因或核苷酸治疗),以及至少包含一种新分子的复合产品(见图1)。
2019年上市的这些药物涵盖了一系列广泛的治疗领域和罕见病。其中,一半以上的NAS获批孤儿药,24%的NAS用于治疗血液系统恶性肿瘤和其他肿瘤适应症,包括淋巴瘤、乳腺癌和膀胱癌等,18%用于神经类疾病的治疗,16%属于传染病用药。在神经系统领域,大多数上市的药物针对那些存在严重未满足需求的罕见病,如脊髓性肌萎缩症(SMA)和杜氏肌营养不良症,而在传染病领域则包括关键性疫苗、热带疾病用药及其他被忽视的疾病治疗药物。
尽管越来越多的专科和罕见病药物上市,但从首次申请专利到正式上市,这些疗法的研发进展仍然缓慢,平均研发时间没有显著变化。2019年,从科学突破到药物上市,平均耗时超过15年,研发周期中位数为13.7年,接近2018年NAS 13.6年的研发时长。
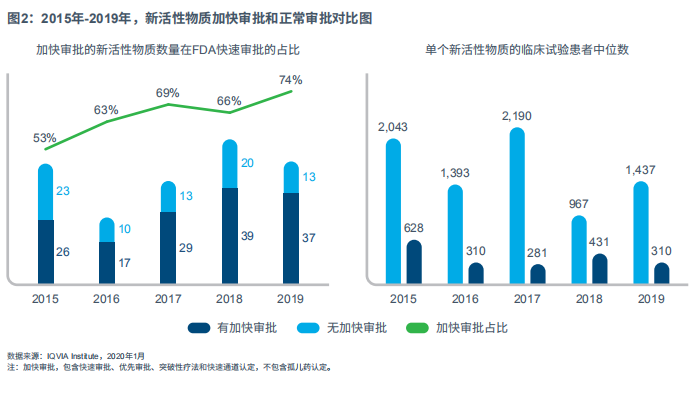
在罕见病领域,药物研发进展迅速。FDA(美国食品和药品管理局)已经为严重疾病用药或未被满足的临床需求药物制定了一系列加速审批程序,即优先审评、突破性疗法审评、快速通道审核以及加速审批途径。自2015年以来,获得加速审批的NAS的比例稳步上升,2019年,共有37种NAS产品(占比74%)至少获得一种加速审评资格(见图2)。
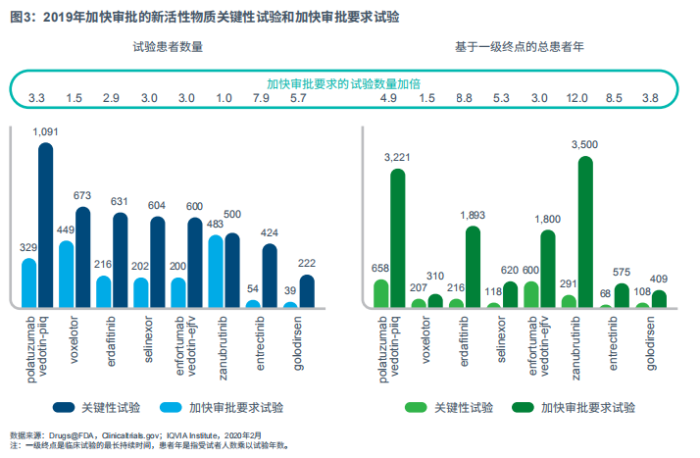
FDA在加速创新疗法审批的同时,也兼顾了速度和质量的平衡,包括要求制造商进行额外验证和IV期临床试验。2019年加速审批的药物所需上市后临床试验的平均受试者数量是关键性临床试验的三倍,受试年数为其六倍(见图3)。这表明FDA试图将支持临床受益和安全性的大量证据收集工作转移到上市后阶段,来平衡未满足需求的治疗紧迫性。
丰富的药物创新
2019年,新上市的药物在新作用机制、精准度和个性化药物、孤儿药和专科药物数量方面都有巨大创新,进一步推动这些类型新药的研发计划。2019年,40%的NAS被FDA认定为首创新药(被FDA列为创新疗法的药物,其作用机制不同于现有疗法),自2011年以来,首创药物数量几乎翻了一番。用于治疗慢性、复杂或罕见病的专科药物占所有NAS的70%。7种NAS产品在治疗过程中推荐或要求使用特异性生物标志物,通过使用预测性生物标志物将潜在患者分类,从而找到受益最大的患者群。例如,alpelisib(Piqray)成为治疗乳腺癌的第一种PIK3CA疗法,扩大了晚期转移性乳腺癌的治疗范围。总体而言,2019年预测性药物的数量有所下降,这一数值在2018年和2017年分别为12种和11种,这表明在识别和开发与临床相关的预测性生物标志物方面存在挑战。
2019年,罕见病和基因疗法有重大突破,3种新型核酸疗法获批:
Onasemnogene abeparvovec-xioi(Zolgensma)是一种潜在的SMA治愈性基因替代疗法,它可以替代失效或缺失的SMN1基因。这是美国第二个获批的基因疗法。
Golodirsen(Vyondys53)是用于治疗杜氏肌营养不良症的第二种反义寡核苷酸疗法。
Givosiran(Givlaari)是一种RNA(siRNA)小干扰疗法,用于治疗急性肝性卟啉病,即四种极其罕见的基因疾病:急性间歇性卟啉病(AIP)、遗传性卟啉病(HCP)、多样性卟啉病(VP)及ALA脱水酶缺乏性卟啉症(ADP)。
非NAS疗法的显著贡献
2019年,非NAS产品在患者治疗方面也取得了进展,在传染病、心血管/代谢、肿瘤和中枢神经系统疾病的综合治疗方面均可圈可点。
传染病
艾滋病和丙型肝炎患者的护理方面有明显改善。
在艾滋病治疗方面,emtricitabine和tenofovir alafenamide(Descovy)获批成为第二种每日口服的药物组合,用于暴露前预防(PrEP),以降低获得性HIV-1感染风险。在此之前,emtricitabine和tenofovir disoproxil fumarate(Truvada)是获得FDA批准的唯一PrEP药物。此外,FDA批准dolutegravir和lamivudine(Dovato)作为治疗成人人体免疫缺陷1型病毒(HIV-1)感染的完整方案。这是针对从未接受过HIV感染治疗患者的首个双药单片治疗方案。
Sofosbuvir(Sovaldi)和ledipasvir/sofosbuvir(Harvoni)获批用于治疗3-17岁儿童和青少年患者,扩大了丙型肝炎的治疗人群范围。丙型肝炎的治疗时间也得以缩短。Glecaprevir和pibrentasvir(Mavyret)获得了FDA的批准,在所有主要丙型肝炎基因型中,将从未接受过慢性丙型肝炎和代偿性肝硬化治疗的患者治疗时间缩短至8周。此前,代偿期肝硬化患者的标准治疗时间为12周或以上。
心血管/代谢疾病
2019年,FDA批准了心血管和代谢领域的几种药物,主要治疗美国两大公共卫生挑战——血脂异常和糖尿病。
SGLT-2抑制剂类目前正被用于治疗与糖尿病相关的其它疾病,dapagliflozin(Farxiga)和canagliflozin(Invokana)分别获批用于治疗糖尿病患者的心血管疾病和糖尿病肾病。Farxiga获批用于降低II型糖尿病患者心力衰竭的住院风险,并获得FDA的快速通道资格和优先审评,用于治疗伴有或不伴有II型糖尿病、射血分数(HF-rEF)降低的心力衰竭患者。
Invokana获得了另一项审批,用于治疗糖尿病肾病,并降低进展为终末期肾病的风险,它是第一种含有肾病适应症的II型糖尿病药物。这表明,虽然这类疗法可能会迅速用于治疗非糖尿病患者的心血管疾病和肾病,但是治疗糖尿病患者并发症的疗法上仍存在重合。同样,用于治疗成年患者甘油三酯水平严重升高(≥500mg/dL)的icosapent ethyl(Vascepa),是FDA批准的首个用于降低高危患者人群心血管疾病风险的辅助药物。
2019年,通过改善患者体验和依从性,糖尿病的治疗得到了进一步提高。
首个非注射性胰高血糖素产品Baqsimi鼻粉剂,以及预混合的胰高血糖素自动注射器Gvoke Hypopen,获批用于严重低血糖的紧急抢救。这些产品为严重低血糖的糖尿病患者提供了重要的治疗方案。在该药物获批之前,胰高血糖素的治疗和给药需要进行多步骤混合和注射,这为急救人员带来了挑战,通常需要定期培训。新的即时救援疗法为糖尿病患者提供了更多的自主权,使他们能够在危难时刻自救。
首个口服GLP-1激动剂semaglutide(Rybelsus)获得了FDA的批准。在此之前,所有GLP-1都需注射。新的口服药物包含与注射剂semaglutide(Ozempic)相同的分子,为希望避免注射的患者提供了更大的灵活性。这项进展可能有助于增加药物的依从性,从而减少糖尿病症状,延缓疾病发展。
在心脏病方面,有几项针对儿童患者的药物审批,增加了这些药物在高需求的弱势患者人群中的应用。
Dalteparinsodium(Fragmin),sacubitril/valsartan(Entresto)和ivabradine(Corlanor)获得FDA批准,可用于儿童治疗。Dalteparinsodium获批用于1个月大的婴儿,以减少症状性静脉血栓栓塞的复发。后两种药物被批准用于治疗1岁和6个月大的婴幼儿心力衰竭。
肿瘤
2019年,针对各种适应症和患者群体的肿瘤疗法取得了进展。
Acalabrutinib(Calquence)被批准用于治疗成人慢性淋巴细胞白血病或小淋巴细胞性淋巴瘤,lenvatinib(Lenvima)获批与pembrolizumab(Keytruda)联用治疗晚期子宫内膜癌。重要的是,acalabrutinib和lenvatinib通过ORBIS计划获得补充性审批,该计划是FDA肿瘤卓越中心发起的一项倡议,为向美国FDA、澳大利亚治疗用品管理局(Australian Treative Goods Administration)和加拿大卫生部(Health Canada)同时提交和审批肿瘤药物提供了一个框架。2019年,pembrolizumab获得监管机构的审批,增加了六种适应症,包括头颈部鳞状细胞癌和食管癌的一线治疗,获批适应症数量超过20种。值得注意的是,PARP抑制剂niraparib(Zejula)获得扩展审批,用于先前接受过治疗的晚期卵巢癌、输卵管或原发性腹膜癌患者,且这些患者为同源重组缺陷(HRD)阳性。2017年,niraparib成为FDA审批的首个不需要BRCA突变或其它生物标志物检测的PARP抑制剂;但2019年,扩展后的适应症与伴随诊断相关联,需要确定HRD状态,使非BRCA阳性(BRCA+)突变的患者能够使用这种靶向治疗。
一些疗法同时也获批用于疾病的早期治疗以及作为前线疗法,扩大了患者的治疗选择。Daratumumab(Darzalex)以前只被用于治疗无药可医的多发性骨髓瘤患者,现在获批用于新确诊的不适合进行骨髓移植的患者。曲妥珠单抗-美坦新偶联物(Kadcyla)还获批用于早期HER-2阳性乳腺癌患者,此前已获批用于HER-2阳性转移性乳腺癌,这是乳腺癌治疗方面的重大进展。
中枢神经系统疾病
2019年,神经疾病和精神疾病治疗方面都取得了重大进展。例如,在神经疾病方面,eculizumab(Soliris)成为首个治疗患有视神经脊髓炎谱系病(NMOSD)的成年患者药物,这种罕见病会引起失明和麻痹,从而导致残疾或死亡。
Cladribine(Mavenclad)在美国被批准用于治疗复发缓解型多发性硬化症(RRMS)和继发进展型多发性硬化症(SPMS),使其成为第二种获批用于SPMS的疾病修饰疗法。此前,Cladribine获批治疗肿瘤,2017年经审批用于美国之外的RRMS治疗。
Galcanezumab-gnlm(Emgality)是2018年首批被批准用于预防偏头痛的降钙素基因相关肽(CGRP)拮抗剂之一,并于2019年成为首个获批治疗阵发性丛集性头痛(在数周或数月内密集发作的头痛)的药物。
2019年,精神疾病治疗取得了重大进展,esketamine鼻腔喷雾剂(Spravato)被批准用于治疗难治性抑郁症。尽管20世纪70年代以来,氯胺酮就已作为注射型麻醉剂获得批准并被使用,但esketamine鼻喷雾剂的获批,解决了实质性未满足需求,该分子具有治疗难治性抑郁症的新作用机制。
临床研发的发展趋势
随机对照和单臂试验
随机对照试验(RCT)仍然是药物审批的黄金标准。自2015年以来,向监管机构提交了随机对照试验的NAS的平均占比为79%,2019年74%的NAS提交了随机对照试验。总体而言,通过单臂试验获批的NAS从2018年的15%增加到2019年的24%。单臂试验在人数偏少的目标人群中有用,因为在这些人群中开展随机对照试验存在挑战,而这一趋势主要由美国不断增加的罕见病NAS上市所推动。
患者报告结局
2019年在美国上市的药物中,近三分之一的药物在适应症说明上注明了患者报告结局(PROs),说明这些指标对于临床结果评估的重要性。对于一些疾病来说,可能没有确定的量化方法来衡量疗效,因此需要使用仪器来记录和测量患者的定性反馈。PRO工具允许患者描述自身健康状况,并可通过自我报告、访谈或特定的PRO评估措施(例如疼痛或睡眠质量表)进行测量。通过数字工具(例如使用电子日志)捕获PRO信息的潜力巨大,但是目前尚不清楚数字工具是否被用于作为2019年NAS申请的PRO证据。2019年新产品适应症说明上,一半以上的PRO是临床试验的主要终点;然而,尽管它们普遍存在,但PRO测量本身并不是新鲜事物,所有问卷都是在2007年以前起草的。例如,NASpitolisant(Wakix)和solriamfetol(Sunosi)的临床试验,使用了20世纪90年代引入的Epworth嗜睡量表(ESS)(8项问卷)评估嗜睡程度,患者通过该问卷来评估他们在日常生活中入睡的可能性。在宏观层面上,PRO所捕获的信息类型可以用作健康评估,以衡量医疗干预措施产生的患者结局,或比较不同医务人员产生的患者结局。从临床试验中和在药品上市后收集并分析患者结局,可能会提高医疗服务质量,从而提升患者报告结局。
真实世界证据
2019年上市的药物越来越重视将真实世界证据(RWE)纳入监管审批文件中。2019年上市的三种NAS(prucalopride(Motegrity),onasemnogene abeparvovec-xioi和entrectinib(Rozlytrek))均在其关键试验中包含了RWE数据。另一种药物palbociclib于2015年上市,2019年又通过使用RWE,取得了补充审批。但监管机构仍对在新药申请中使用RWE持谨慎态度。在获批前的临床试验中使用RWE不同于在上市后使用RWE,因为FDA过去一直使用真实世界数据(RWD)和RWE来监测药品上市后的安全性和不良事件。迄今为止,FDA只批准了18种利用RWE申请初步审批的药物,其中包括在单臂试验背景下用作外部或历史对照,或使用病例报告和扩展方案数据,来取得另外两种补充适应症的批准。然而,FDA准备通过批准《21世纪治愈法》,以及重新授权第六版处方药付费法案,在监管前提下进一步扩大RWE的使用范围。
新产品管线
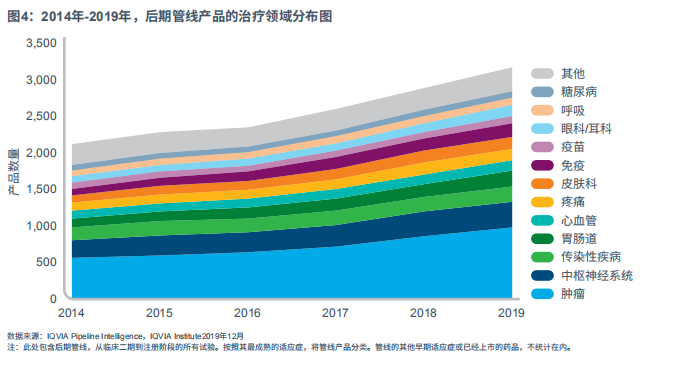
自2014年以来,后期在研管线数量增长率为50%,神经系统、传染病和肿瘤仍然是重点治疗领域,也预示着未来创新药物的方向(见图4)。后期管线共有3169种产品,自2018年以来增加了10%,5年复合增长率为8%。
过去五年中,肿瘤产品数量增加了76%,2019年,肿瘤产品占到后期管线的30%。靶向疗法的增加是主要的增长推动力,从2014年到2019年几乎翻了一番。胃肠疗法在过去5年增长了73%,占2019年管线总量的7%。治疗非酒精性脂肪性肝炎(NASH)的胃肠道产品管线比例显著增加,从2014年的10种上升到2019年的45种,治疗克罗恩病和溃疡性结肠炎的产品也有所增加。
2019年的产品管线中,有11%用于治疗中枢神经系统紊乱疾病,自2014年以来,处于研发阶段的药物数量上升了50%。中枢神经系统疾病的临床研发存在诸多挑战,如缺乏对疾病的完全认识等,但2019年,CNS管线中增加了20个新产品。尽管阿尔茨海默病药物临床试验屡遭失败,但是中枢神经系统管线覆盖了一系列不同的适应症,包括罕见的神经肌肉疾病、精神疾病和神经退行性疾病。特别是自2018年以来,精神类产品增长了27%,达到29种。
传染病产品占2019年后期活跃管线数量的6%,在过去五年里增长了13%。抗菌药物约占传染性疾病药物的30%,共计60多种产品用于治疗革兰氏阳性细菌感染、肺炎和尿路细菌感染等。但是,市场仍然迫切需要新的抗生素来治疗耐药性感染。例如,传染病产品后期管线中仅包含4种抗碳青霉烯类药物,这是抗生素用药的最后一道防线。除了抗菌产品,在传染性疾病中排名第二的药物还包括抗病毒疗法,包括治疗SARS-CoV-2感染的三种抗病毒药物。
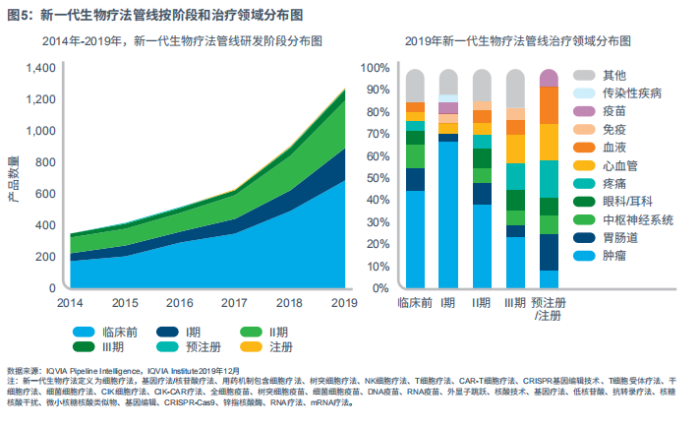
新一代生物疗法
新一代生物疗法,包含细胞、基因和核苷疗法,目前约占研发后期管线的12%,比2018年增加了10%(见图5)。
自2018年以来,生物药新增99个在研产品,在研产品总量增加至369种。随着疾病治疗新路径的发现,治疗需求高居不下(尤其是传统意义上的棘手疾病),投资热度不减,新一代生物药的数量几乎是2014年的三倍。目前,78%的后期新一代生物疗法处在二期,考虑到患者群体的医疗需求,FDA批准三期试验的可能性极高,新一代生物疗法也更容易获批上市。现有管线里的基因疗法和基因编辑技术占到70%,多达278个产品。
处于研发后期的新一代生物疗法产品集中在几个治疗领域,包含肿瘤、肠胃系统、血液疾病和眼科:
肿瘤是后期管线产品最多的治疗领域,占35%的份额,128个产品,主要归功于基因疗法,尤其是CAR-T新药。
肠胃系统产品占后期管线的9%,共计35个产品,其中21个为基因疗法。包括治疗婴儿和儿童的致死性疾病,如黏多糖病、法布里病和苯丙酮尿症。
在血液疾病里,现有21个在研基因疗法和CRISPR产品,血友病和地中海贫血的疗法有望在2020上市。另一个治疗地中海贫血和镰状细胞病的后期产品是CRISPR产品,为基因编辑自体造血干细胞疗法。
受治疗遗传性视网膜疾病Luxturna成功上市的影响,以及基因疗法用药和靶向的便捷性,眼科将继续成为关注的焦点,现已集中了24个后期在研疗法。后期的CRISPR产品是用于治疗先天性黑蒙的,这一疾病影响婴儿视力,甚至导致失明。
尽管药物量产还面临困难重重,耐药性和患者可及性也充满疑问,但基因疗法及相关技术依旧是新药研发的焦点,未来前景可期。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐