真实世界证据——实现产品卓越上市的战略资产
- 2020-12-03 13:21
- 作者:
- 来源: 艾昆纬
拥有真实世界证据(RWE),已经成为药企在市场竞争中的战略性差异化优势,卓越的药企先觉先知,已将RWE融入产品上市策略中。那么,如何运用RWE?何时开始RWE的生成?RWE关注的重点有哪些?
为了解不同的RWE策略在产品成功上市中所起的作用和影响,笔者基于PubMed和Embase上的实效性文献,对2019年12月以前发表的每个产品上市的所有相关RWE进行量化分析。研究主要集中在糖尿病、免疫和免疫肿瘤药物这三个竞争非常激烈的领域。具体而言,研究内容包括了以下药物类别的上市情况:糖尿病:GLP-1受体激动剂;SGLT-2抑制剂。免疫:白细胞介素抑制剂,包括IL-12/23、IL-17、IL-23、IL-4/13;PDE-IV抑制剂和JAK抑制剂。免疫肿瘤学:检查点抑制剂,包括PD-1和PD-L1。
笔者对实效性文献进行了RWE生成模式分析,包括:整个产品生命周期内的总量(即相关搜索的点击量),根据FDA批准的适应症数量及其上市时间进行标准化。产品生命周期中不同时间点的年证据量。随时间推移并按照证据关注点分类的年证据量,根据摘要信息可将文献中的RWE分为七个类别:有效性、安全性、生活质量(QoL)、临床实践、疾病特征、患者特征和卫生经济学。 基于IQVIA对“卓越”的定义,笔者将此次证据量分析结果与药物上市类型叠加,即分为卓越与非卓越上市,以及首创性新药与跟进性药物。这项系统性分析揭示了在药物上市背景下RWE的生成模式,并帮助确定为实现成功上市所需采取的RWE策略。它提供了关键问题的答案,例如:在类似的竞争水平上需要多少证据?证据应该关注哪些方面的问题?这些证据关注点在产品生命周期中如何变化?
以下是笔者通过在这三个治疗领域的研究,得出的主要发现。
产品获批上市前一年,RWE的输出力度大幅增加
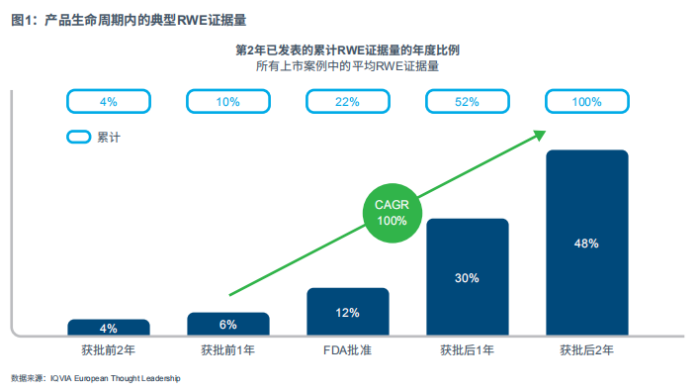
考虑到多产品分析,笔者对时间线和已公布的RWE证据量进行了标准化处理。首先,以产品获得FDA批准时间为基准点,研究覆盖产品获批前2年到获批后2年。针对不同上市产品的年度公开RWE证据量进行标准化处理,换算为在此期间产生的RWE绝对总量的一部分。
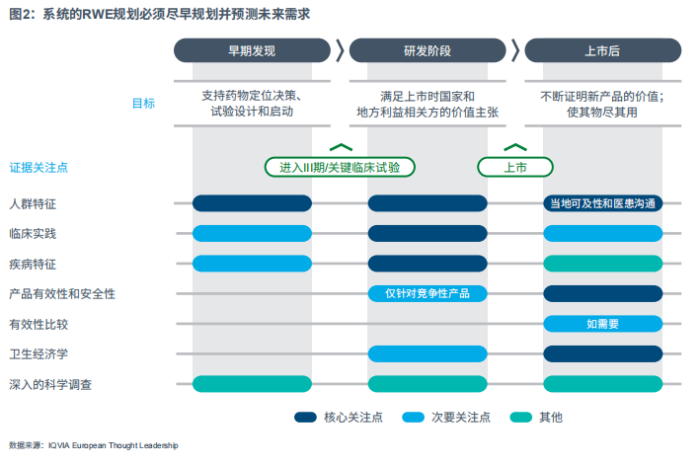
在所探讨的药物上市案例中发现了一种普适模式:通常,RWE在产品获批前2年就已经开始输出,尽管此时的输出力度较低,但会一直持续到上市获批前1年。但随后RWE的证据量曲线开始急剧上升,且公布的RWE证据量逐年翻番,获批前1年到获批后2年这一期间的复合年增长率(CAGR)为100%。从这种模式中我们可以得到直接的启示是:我们需要一种全面、主动的方法来生成证据。由于生成RWE的典型交付时间通常为12-18个月,结合利益相关方的需求,为了能够及时生成并交付此类RWE证据量,必须至少在产品获批前2-3年尽早开始系统性的证据规划(见图1/图2)。
卓越上市加快生成更多RWE
如何利用RWE实现卓越上市?为了回答这一问题,笔者采用两种指标来对比产品的卓越和非卓越上市:
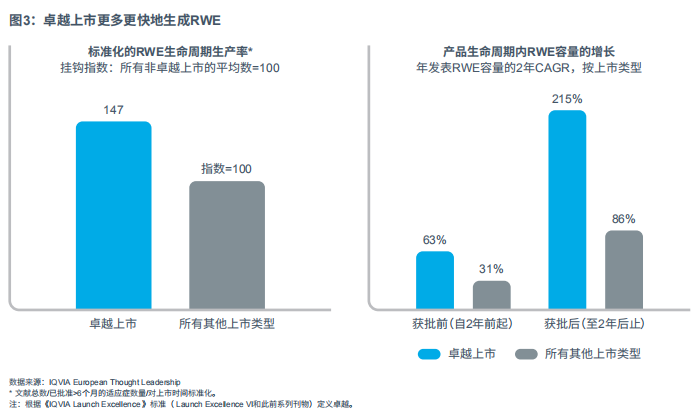
标准生命周期RWE生成量:这是产品整个生命周期中产生的RWE总量,除以上市至少6个月的适应症的数量;并对这些适应症在市的时间进行标准化处理。
产品生命周期内RWE年证据量的增长:我们分别调查了在两个时期(获批前2年和获批后2年)RWE年证据输出量的2年CAGR。
结果很明确:卓越上市比非卓越上市产品能生成更多的证据,并且卓越上市的产品在获批前和获批后的2年内,能更快生成证据,RWE证据量曲线更陡峭。
这一发现具有许多重要的意义:首先,这表明卓越上市产品在利用RWE方面目的更明确,且在早期的证据规划时更为规范,以期建立数据量稳步上升的生命周期证据图。其次,卓越上市在证据生成方面具有竞争力,助力执行这一具有挑战的证据实施策略。第三,基于一次性研究的传统证据生成方法不足以维持高水平的RWE生成,企业需要运用能够提高效率、灵活性和速度的创新方法,例如,利用证据平台和“二手数据”。从卓越上市更为陡峭的RWE数量曲线来看,卓越上市似乎涵盖了此类创新方法。
显然,卓越上市确实赢得了RWE证据之战(见图3)!
卓越上市体现了企业对RWE的重视程度
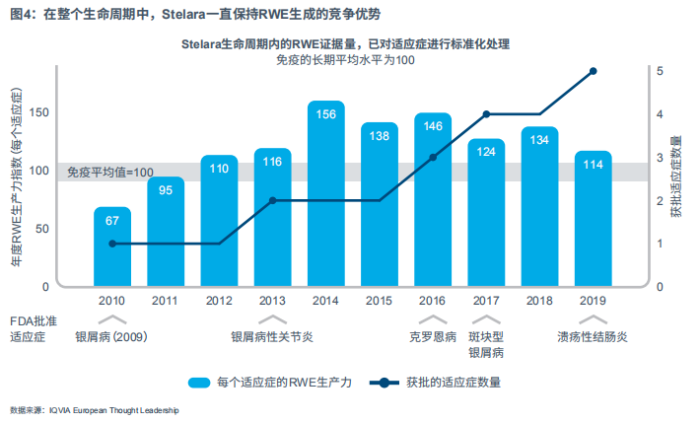
通过卓越上市更快更多地产生RWE的策略,在产品获批的2年后会继续延续下去。实际上,笔者发现卓越上市也显示了企业致力于RWE的决心。在药品上市后多年,他们仍保持RWE生成率高的竞争优势,直至进入产品成熟期。
杨森公司旗下用于治疗自身免疫性疾病的白细胞介素12/23抑制剂Stelara就是一个很好的例子。Stelara于2009年首次获批用于治疗银屑病。自此之后,Stelara的获批适应症范围逐渐扩大,包括2013年获批治疗银屑病性关节炎、2016年获批治疗克罗恩病、2017年获批治疗斑块型银屑病、2019年获批用于治疗溃疡性结肠炎。
Stelara不仅在早期的RWE生成指标方面胜过竞品,而且在整个生命周期中仍保持着具有竞争力的RWE生成水平:即使获批的适应症数量越来越多,每个适应症的年均公开RWE证据量仍保持在高水平。图4分析表明,即使在首个获批的适应症中,情况也是如此。
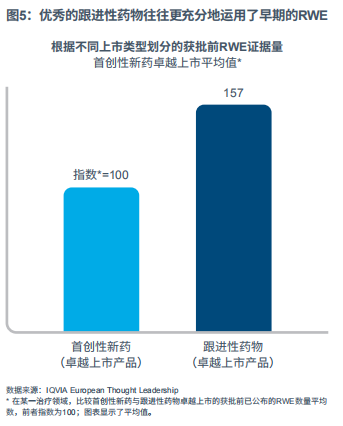
优秀的跟进性药物往往更多地运用早期的RWE
卓越上市并不是定义药物上市情况的唯一标准。上市顺序是另一个重要的维度,对上市策略等诸多方面具有决定性作用。
在公开的RWE基础上,笔者发现了首创性新药和跟进性药物之间在卓越上市方面的显著差异。这两种上市类型在产品生命周期中,特别是在获批前和获批后阶段的累计输出RWE证据量的相对分布有所不同(见图5)。
优秀的跟进性药物制药企业往往更充分地利用了早期的RWE。笔者通过研究跟进性药物运用早期RWE的独特优势,找到了这一策略的合理解释。
跟进性药物可以洞悉与之正面竞争的在市药物,例如他们目前在真实世界中的表现。跟进性药物可以对患者细分、临床实践、疾病负担和未被满足的需求有更深入的了解,以确定现有药物尚未满足需求中的潜在机会,并向医疗利益相关方强调此类机会。这种洞察能够使跟进性药物调整上市策略,包括最佳市场定位、目标人群或如何无缝对接当前的临床实践等。
由于跟进性药物将要进入的是一个几近饱和的市场,在不同程度上存在着同类竞争,相比首创性新药的上市,它们更需要凸显自己的差异性,更需要在治疗领域中占领市场份额。优秀的跟进性药物制药企业似乎在其关键策略选择中更倾向于运用早期RWE,其结果也是颇有益处的。
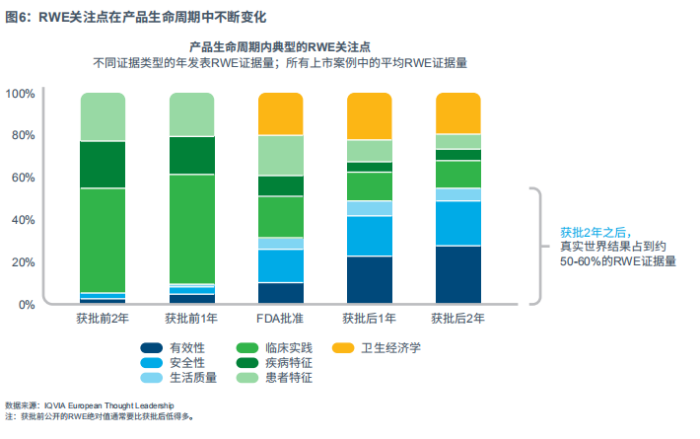
RWE关注点在产品生命周期中不断变化
除了证据生成能力外,影响RWE运用的另一个重要维度是:RWE应该关注哪些方面?在产品生命周期中如何演化?
为此,笔者从七个不同的关注点对RWE文献进行分类:有效性、安全性、生活质量(QoL)、临床实践、疾病特征、患者特征和卫生经济学。笔者比较了药品获批前2年到获批后2年这段期间,在RWE年证据量中的相对比例。
作为上市案例典型模式,笔者发现在产品获批前,RWE关注点侧重于市场和疾病洞察,例如患者特征、疾病特点和临床实践。一旦新产品上市,卫生经济学和真实世界结果将成为关注焦点,包括(比较)有效性、安全性和生活质量(QoL)。获批后两年,真实世界结果则成为最大的类别,占年公开RWE证据量的一半以上(见图6)。
这种关注点的转移,反映了一旦产品上市,药企需持续应对利益相关方的审查,并在真实世界条件下体现产品价值的需要。
显然,生命周期证据策略对于最大程度提高RWE的影响至关重要。从战略上来说,RWE关注点会随时间变化,不断顺应利益相关方的不同需求,从而确保其持续相关性。如前所述,考虑到RWE生成的交付时间,提前规划利益相关方的需求至关重要,以确保在合适的时间提供相关的证据。
由于没有观察到卓越上市和非卓越上市之间RWE关注点的模式差异,因此笔者认为“卓越”并不是RWE关注点变化的一个重要驱动因素。但是,笔者发现了其他有趣的变化,下文详细说明。
不同治疗领域的趋势差异
除了从不同上市类型观察到的这些大趋势之外,笔者还发现了各个治疗领域之间的一些显著差异,包括特定治疗领域的独特模式。
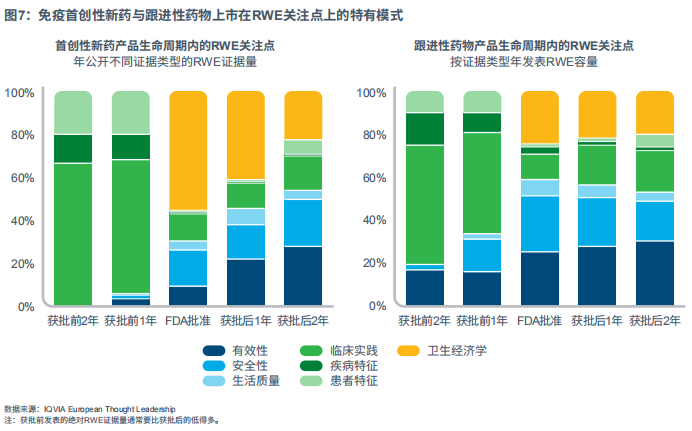
免疫治疗
在免疫药物上市中,笔者发现了首创性新药与跟进性药物上市的RWE关注点差异。从获批前2年到获批后1年,各自的模式差异很大,但在获批后2年左右开始趋同(见图7)。
首创新药上市:
获批前的证据关注点在于临床实践、患者特征,还有疾病特征,这有助于深入了解治疗情况或未被满足的患者需求。产品获批后,前期的证据关注点在于卫生经济学方面,随后转变为真实世界结果,并成为最大的类别。
跟进药物上市:
获批前,除了首创性新药外,跟进性药物很早就对在市竞品的真实世界结果有所关注。背后一个可能的原因是,跟进性药物对潜在机会有更全面的了解,同时需要确定他们与已上市的首创性新药差异性的竞争定位。产品获批后,对比首创新药的上市情况,跟进性药物更多地关注真实世界结果,而非卫生经济学方面。尽管总体关注度仍处于中等水平,但跟进性药物企业也很关心临床实践。同样,这可以帮助跟进性药物凸显差异性、优化市场竞争定位。
此外,笔者还观察到了免疫药物的特定类别模式,这些模式直接反映了RWE需要在这些产品中解决的特定问题。JAK抑制剂正面临血栓和栓塞发生率增加的问题,导致FDA将此类风险视为一种类效应,并对三种已获批的JAK抑制剂Xeljanz、Olumiant和Rinvoq标示了黑框警告。因此,在JAK抑制剂获批后,以安全性为关注点的RWE占所有免疫上市药物中已公布的RWE证据量平均比例的两倍以上,这也在预料之中。
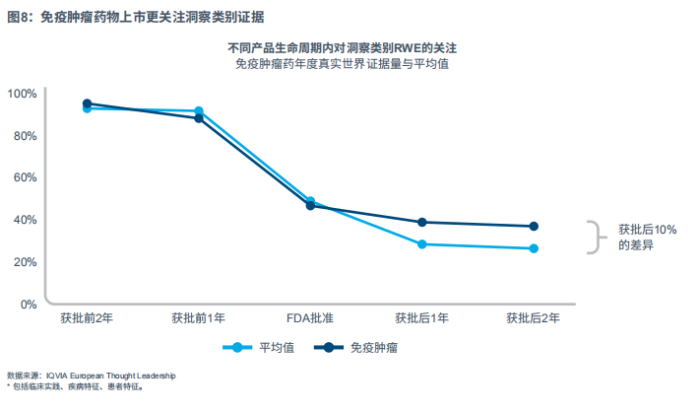
免疫肿瘤治疗
与产品生命周期内RWE关注点演变的大趋势相比,笔者观察到免疫肿瘤药物上市更关注洞察类的RWE,包括患者特征、疾病特征和临床实践(见图8)。
在获批后的2年中,笔者发现免疫肿瘤药物产品发布的证据在RWE年证据量中的比例,比平均药物高出约10个百分点。这种差异很大程度上是以减少卫生经济学证据为代价。
回顾相关文献摘要中的信息,笔者发现免疫肿瘤药物上市会生成真实世界洞察,回答一系列基础疾病和临床实践的相关问题,例如:在常规临床实践中有效使用生物标志物和伴随诊断(CDx)作为疾病进展或免疫肿瘤治疗反应性的预测因子;免疫肿瘤产品在现有治疗领域的适用性,例如如何与其他药物联用,或在治疗线中对不同方案进行排序;在常规临床实践条件下,处理免疫肿瘤产品的剂量和滴定,尤其是在联合治疗方案中;了解不同人群的自然疾病史,以及如何影响不同患者的治疗决策。
免疫疗法高度创新,代表了癌症治疗领域真正的颠覆性革新,考虑到这一点,免疫疗法与相对渐进的创新相比,尚有诸多需要解答的基本问题,尤其是在新产品进入常规临床实践后。免疫肿瘤产品上市后对洞察类RWE持续、大量的关注,似乎反映出这些特殊挑战。
糖尿病
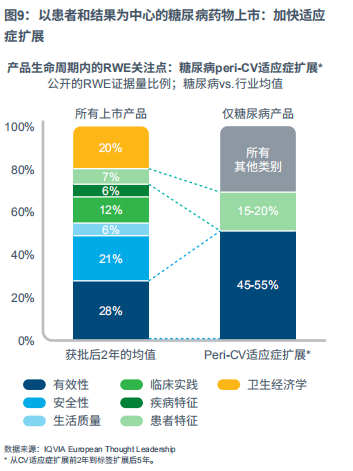
糖尿病产品上市大致遵循普通模式,即在首次获批前后的2年时间内,RWE的关注点会随时间演变。但是,当笔者分析了不同药物(即GLP-1受体激动剂和SGLT-2抑制剂)的生命周期后期,发现公开的RWE关注点发生了有趣的变化。
在扩展到心血管(CV)适应症的前2年到扩展后5年期间,RWE的重要关注点主要集中在真实世界中的有效性和患者特征这两类。在获批后的2年或更长时间内,这些类别的证据量比例增加到笔者所观察的所有上市产品均值的两倍以上。
由于心血管疾病是导致糖尿病患者死亡的重要因素,因此控制心血管风险同时降低葡萄糖水平对于糖尿病的综合管理至关重要。GLP-1激动剂(尤其是SGLT-2口服抑制剂)对心血管疾病的有效控制使其大受市场欢迎。
糖尿病是一种典型的基础医疗疾病,全球约有数亿糖尿病患者。小规模患者的心血管结局试验(CVOT)结果,如何扩展到更为广泛复杂的糖尿病人群,让更多患者获益,才是真正的挑战。而这正是RWE可以发挥优势的地方。RWE能代表常规治疗中更广泛、更多样化的糖尿病患者群体,同时进行长期随访得出更多洞察,来补充和证实随机临床试验。
这也是笔者观察到的事实,主要的糖尿病制药公司在进行CVOT的同时广泛使用RWE,包括进行数十万患者的大规模、里程碑式的真实世界研究,例如,阿斯利康的CVD-REAL研究,勃林格殷格翰/礼来的EMPRISE研究。
在缩小CVOT与真实世界间证据差距方面,RWE有着无法估量的作用。这一点也正逐渐得到监管机构、HTA和指南制定机构的认可(见图9)。
结论
在如今的药物上市环境下,RWE已成为战略差异化的一条新战线。卓越上市的企业已经充分意识到这一点,并将RWE视为赢得竞争优势的一把利剑。
为了充分发挥RWE的战略潜力,制药公司需要以下优化处理证据的方式:
1.真实世界证据需要上升到战略层面,以获得高层和管理层的认可和协作,他们往往对产品成功上市负有最终责任,并且也是证据投资的关键决策人。
2.企业必须以一种竞争的心态来直面证据生成问题——如何在竞争激烈的市场中脱颖而出,赢得一席之地。
3.企业需要制定全面综合的产品生命周期证据计划,尽早从利益相关方的预期需求出发,确保RWE的关注点随时间与不断变化的需求保持一致,同时填补RCT留下的证据缺口。
4.企业必须对RWE坚定信心,在执行生命周期证据计划方面保持具有竞争力的投资水平,并持续在产品上市后多年内,维持有竞争力的RWE生成水平。
5.作为提供和维持具有竞争力的RWE生存水平的先决条件,企业需要建立世界一流的RWE能力,例如证据平台,参与卫生系统证据网络并在证据生成方面进行创新,例如“优先二手数据”或新颖的研究设计。
笔者认为,企业需要将RWE视为一种真正的战略资产和差异化因素,而不是一种可有可无的东西,这种战略转变可使制药公司赢得新的竞争优势,更好地帮助产品实现卓越上市。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
- 2019年美国新药研发大盘点
-
为你推荐