2020盘点:FDA批准的53个新药(一)
- 2020-12-28 16:09
- 作者:魏利军
- 来源:中国食品药品网
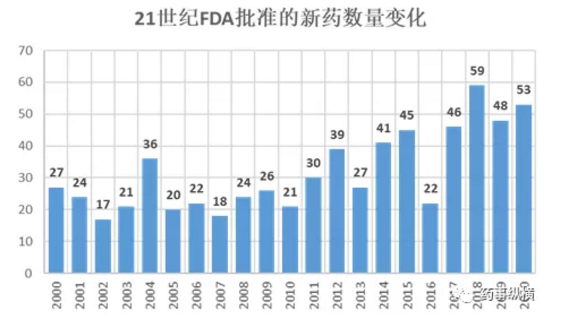
截至2020年12月27日,美国FDA已批准53个新药上市,包括38个小分子化药、13个生物药和2个RNA。
1.Ayvakit(avapritinib)
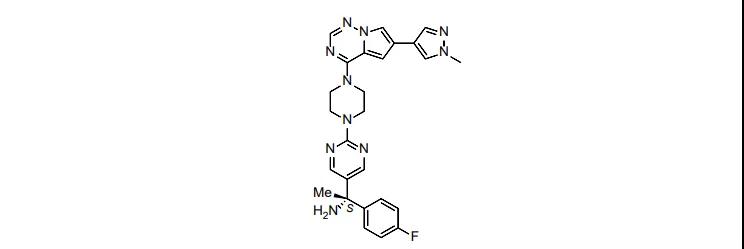
1月9日,FDA批准了Blueprint Medicines公司的avapritinib,用于阿尔法血小板衍生生长因子受体(PDGFRA)基因外显子18突变阳性,且无法手术切除或转移性的成人胃肠间质瘤患者治疗。胃肠间质瘤是一种比较罕见的肿瘤,美国每年新发病例为5000-6000人[i],其中大约有10%左右的病例携带PDGFRA基因突变。本品是首个PDGFRA基因突变的胃肠间质瘤的针对性疗法。在市场潜力方面,Evaluate Pharma(EVP)预测该产品在2026年的销售额为9.18亿美元。
2.Tepezza(teprotumumab-trbw)
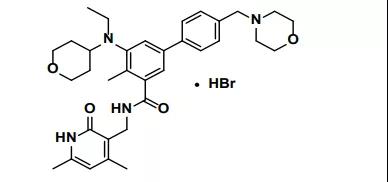
1月21日,FDA批准了Horizon Therapeutics的teprotumumab,用于甲状腺眼病治疗。甲状腺眼病又称Graves眼病,是一种自身免疫相关的疾病,年发病率为19/10万[iv],该疾病在美国患病率相对较低,根据美国罕见疾病组织(NORD)数据,女性患病率为16/10万,男性患病率为2.9/10万[v]。Teprotumumab是首个获批用于甲状腺眼病治疗的药物,市场潜力巨大。根据该公司三季度财报,该产品在前两个季度的销售额就已达4.76亿美元,并且预测2020年的年销售额将超过8亿美元[viii],而EVP仅预测该产品在2024年的年销售额为4.84亿美元。
3.Tazverik(tazemetostat)
1月23日,FDA加速批准了Epizyme公司的tazemetostat,用于转移性、局部转移性或无法手术根除的晚期上皮样肉瘤治疗。上皮样肉瘤是一种非常罕见的软组织肿瘤,不足软组织肉瘤类型的百分之一,据估算美国仅有数百名患者。Tazemetostat是一种甲基转移酶抑制剂,可阻断EZH2甲基转移酶的活性,进而阻止癌细胞的生长,是首个获批用于上皮样肉瘤的治疗药物。在市场潜力方面,EVP预测该产品在2024年的销售额为5.56亿美元。
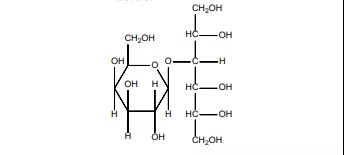
4.Pizensy(乳糖醇)
2月12日,FDA批准了Braintree公司的乳糖醇,用于成人慢性特发性便秘(CIC)治疗。乳糖醇是一种渗透型泻剂,与乳果糖一样,是经典的“泻”药,最早于1993年在西班牙获批上市。除了便秘,西班牙还批准乳糖醇用于肝性脑病治疗。
5.Nexletol(bempedoicacid)
2月21日,FDA批准了Esperion Therap公司的bempedoicacid,用于在饮食控制和他汀类最大耐受剂量治疗下,仍需要进一步降低脂蛋白(LDL-C)的杂合子高胆固醇血症或动脉粥样硬化的心血管疾病患者治疗。Bempedoicacid是一种新型口服降脂药,可通过抑制三磷酸腺苷-柠檬酸裂解酶(ACL)的活性,降低肝脏对LDL-C的合成。在市场潜力方面,虽然本品面临着PCSK9抑制剂的竞争,但美国有超过50%的患者对他汀类不耐受或单独使用他汀类无法有效控制血脂,EVP预测本品在2024年的销售额为7.16亿美元。
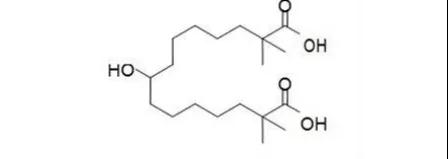
6.Vyepti(eptinezumab-jjmr)
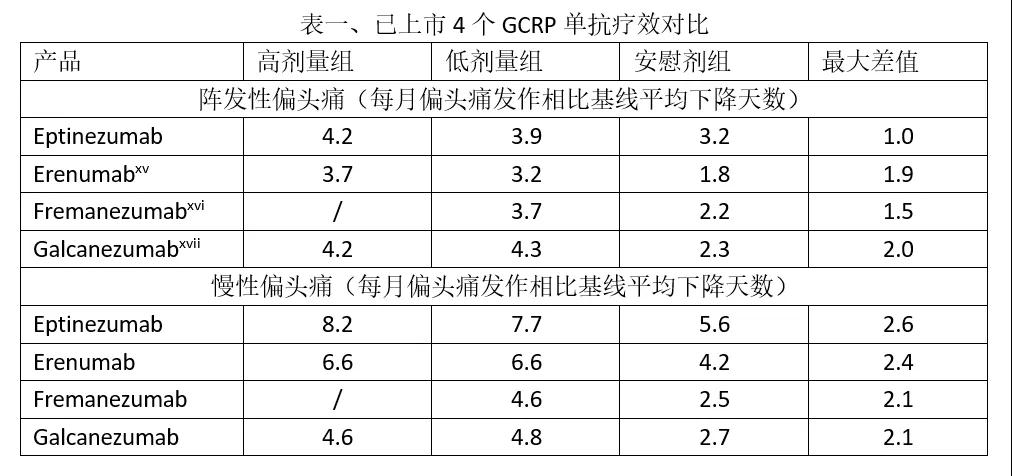
2月21日,FDA批准灵北的降钙素基因相关肽(CGRP)单抗eptinezumab上市,用于预防性治疗偏头痛。市场方面,CGRP靶点竞争较为激烈,此前FDA已经批准安进诺华的erenumab、梯瓦的fremanezumab、礼来的galcanezumab和Biohaven的rimegepant,EVP预测本品在2024年的销售额为4.04亿美元。
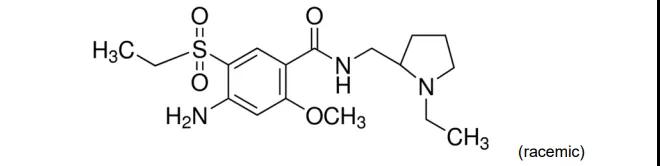
7.Barhemsys(氨磺必利)
2月26日,FDA批准Acacia公司的氨磺必利注射液上市,用于预防和治疗术后呕吐。氨磺必利是一种多巴胺D2和D3受体阻断剂,上世纪80年代开始应用于精神分裂症治疗。在市场潜力方面,EVP预测本品在2024年的销售额为1.03亿美元。
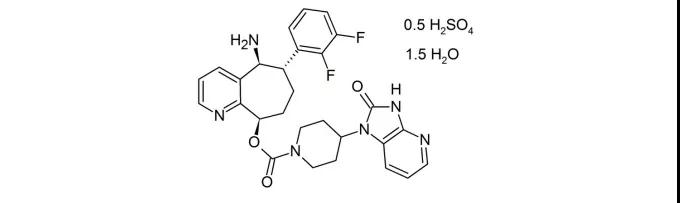
8.NurtecODT(rimegepant)
2月27日,FDA批准Biohaven公司的口服CGRP抑制剂rimegepant,用于成人偏头痛的急性治疗。Rimegepant不同于CGRP单抗,该产品的定位是快速止痛,为了加快药物的起效速度,Biohaven还将其制成了口崩片。在市场潜力方面,rimegepant是第一个口服CGRP抑制剂,市场定位也与CGRP单抗不同,EVP预测该产品在2024年的销售额可达8.68亿美元。
9.Sarclisa(isatuximab-irfc)
3月2日,FDA批准赛诺菲的isatuximab上市,适应证为联合泊马度胺和地塞米松用于既往接受过两种以上疗法(包括泊马度胺和蛋白酶体抑制剂)的多发性骨髓瘤(MM)治疗。Isatuximab是一种Anti-CD38抗体,通过抑制其ADP核糖环化酶(ADP-ribosylcyclase)活性而发挥生理作用。多发性骨髓瘤是一种较为少见的肿瘤,美国国家癌症研究所数据显示,美国2020年将有32270名新发病例和12830名死亡病例[xxv]。在本品获批之前,FDA已经批准了强生的CD38抗体daratumumab上市。相比isatuximab,daratumumab获准的应用范围更加广泛,而且可以实现皮下注射治疗,是本品最强的竞争对手。EVP预测本品在2024年的销售额为5.16亿美元。
10.Isturisa(osilodrostat)
3月6日,FDA批准了Recordati公司的osilodrostat片,用于不适宜垂体手术或经过手术未治愈的成年库欣病患者治疗。库欣病是由垂体瘤引起,垂体释放出过多促肾上腺皮质激素引起肾上腺皮质醇合成过量,进而引发一系列的临床症状。库欣病是一种极为罕见的疾病,NORD数据显示,该病的年发病率仅百万分之十三[xxvi]。Osilodrostat是一种皮质醇合成抑制剂,可抑制11β-羟化酶的活性,阻断肾上腺合成皮质醇。在市场潜力方面,EVP预测本品在2024年的销售额为4000万美元。
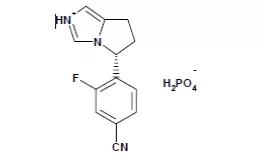
11.Zeposia(ozanimod)
3月25日,FDA批准Celgene的ozanimod,用于治疗成人复发型多发性硬化症(RMS),包括临床孤立综合征、复发缓解性疾病、活动性继发进展性疾病。Ozanimod是一种鞘氨醇1-磷酸(s1p)受体调节剂,与s1p受体1和受体5有非常高的亲和力,但在RMS中的作用机制尚不完全清楚。除了RMS,ozanimod正在开发的适应证包括克罗恩病和炎性肠病。EVP预测本品在2024年的销售额为9.66亿美元。
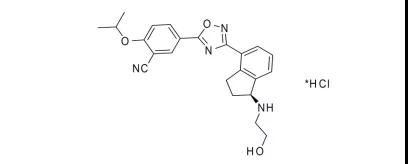
12.Koselugo(selumetinib)
4月10日,FDA批准了阿斯利康的selumetinib,用于两岁以上、无法手术的1型神经纤维瘤(NF1)患者治疗。NF1是一种非常罕见的疾病,估计每3000个婴儿中会出现一个患者。selumetinib是首个批准用于该疾病的药物。除了NF1,阿斯利康还在开发胶质瘤、甲状腺癌等适应证。EVP预测本品在2026年的销售额可达0.84亿美元。
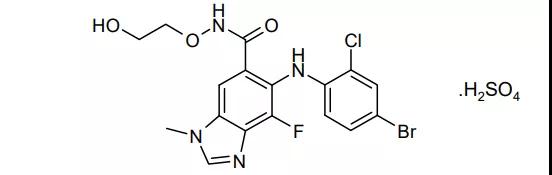
13.Tukysa(Tucatinib)
4月17日,FDA批准Seattle Genetics公司的Tucatinib上市,适应证是与曲妥珠单抗和卡培他滨联用,治疗晚期无法手术或转移性的HER2(人表皮生长因子受体-2)阳性乳腺癌成人患者,包括既往接受过1种以上HER2治疗方案的脑转移患者。HER2阳性患者约占乳腺癌总病例数的五分之一。除了乳腺癌,本品还在开发直肠癌等适应证。EVP预测本品在2026年的销售额为9.50亿美元。(药事纵横 魏利军)
本文的销售额预测数据均来自Evaluate Pharma网站公开文章。本文已征得作者同意刊发,未经许可不得转载。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐












