他山之石 | 老年患者用药标签的内容和格式
- 2021-02-20 15:09
- 作者:
- 来源:中国食品药品网
1997年,FDA为了完善处方药及生物制品关于老年人(65岁及以上)用药的信息,在人用处方药标签“注意事项”中建立了“老年患者用药”部分(21CFR201.57(f)(10))。因此,许多申请持有人应按照21CFR314.70或601.12的要求提交老年患者用药标签的补充申请。这些补充申请需要在实施前经相关机构批准,以下情况除外:
●按照314.70(c)(2)或§601.12(f)(2)中的要求,标签添加或改变注意事项、剂量和给药途径的;
●按201.57(f)(10)(ii)(A)要求提交标签更改的(例如,现有的数据不足以确定老年患者用药后的反应不同于年轻患者的反应)。
申请持有人对提交修订后标签的责任
根据老年患者用药标签规定,需提交有关老年患者用药标签补充申请的药品可以分成三类(表8-1)。第一类中包括所有已批准新药上市申请(NDA)或生物制剂许可申请(BLA)以及在参比制剂列表中的仿制药上市申请(ANDA)的上市药品,提交的资料应包括修订后的标签和支持修订的数据。第二类包括未经批准但已上市的药品,已批准NDA、BLA或ANDA但未上市的药品和非处方(OTC)药,不需要提交任何资料。第三类(例如,已批准ANDA且已上市但不在参比制剂列表中药物产品),当药品标签为增加老年患者用药相关信息而进行修订时,应根据橙皮书中经批准上市的参比制剂的标签进行修订,并提交修订后的标签。
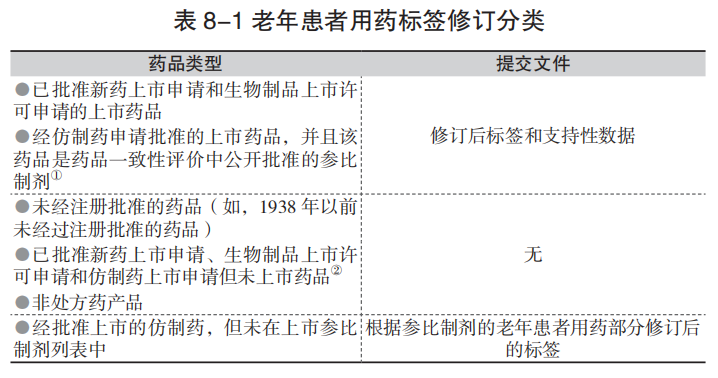
注:①一些仿制药申请产品可能仅仅因为与原研药相比剂型不同(如,片剂和胶囊)就被指定为参比制剂,但它们的标签仍然与原研药标签一致(例如,NDA持有人的标签发生变化(原研药),ANDA持有人的标签也进行同样的变更)。在这种情况下,ANDA持有人需要提交关于老年患者用药信息的补充申请或没有此方面信息时,提交承诺将与原研药标签的变更保持一致的补充申请。ANDA药品是参比制剂且市场上没有对应的原研药时,ANDA持有人应提交老年患者用药部分的补充申请。②如果申请持有人决定继续上市销售某药品,那么在上市前需要提交老年患者用药标签的补充申请。
老年患者用药标签相关法规的实施
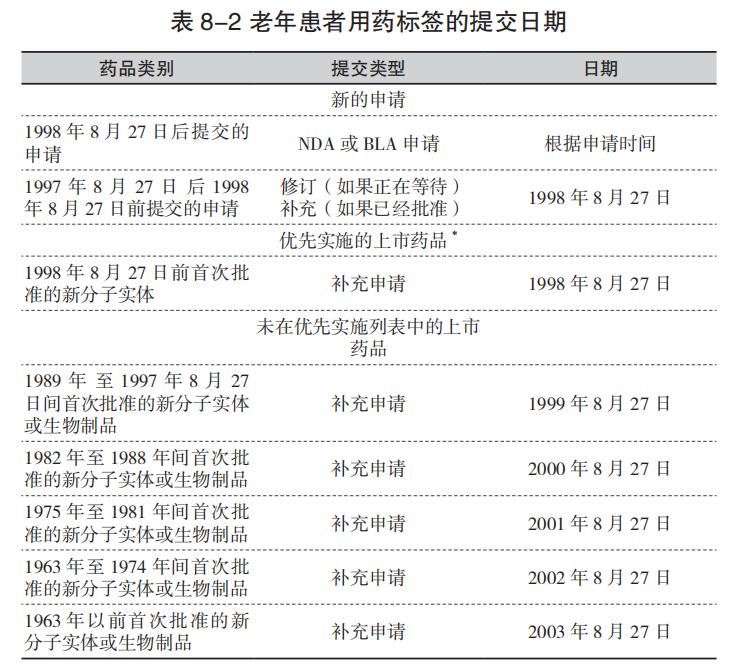
老年患者用药标签的相关法规(62FR45313)为在1998年8月27日此法规生效前批准的产品提供了不同的执行日期。因为某些类别的药品会对老年患者造成潜在不良影响,这些药物标签的变更应优先实施并在1998年8月27前提交至FDA(62FR45320)。以下几类药品应优先实施标签的变更:
●精神药品(抗抑郁药、抗焦虑药、安眠药、抗精神病药物);
●非甾体类抗炎药(NSAIDs);
●地高辛、抗心律失常药、钙通道阻滞剂;
●口服降糖药;
●抗凝血剂;
●喹诺酮类。
对于不在优先类别中的上市药品,计划实施时间取决于药物产品新分子实体(NME)(活性成分)或生物制品许可首次批准的时间。表8-2总结了提交老年患者用药标签的日期。1998年8月27日之后提交的任何申请,标签中必须包括老年患者用药部分(201.57(f)(10))。对于目前正在审查的新药申请,应提交已增加老年患者用药部分的标签作为补充申请。
注:*优先实施的上市药物为精神药品,非甾体类抗炎药(NSAIDs),地高辛、抗心律失常药、钙通道阻滞剂,口服降糖药,抗凝血剂,喹诺酮类。无优先实施的生物制品。
在橙皮书中被列为参比制剂的仿制药的标签如果与原研药的标签不一致,仿制药申请持有者应提交一个老年患者用药标签的补充申请。不在橙皮书参比列表中的所有仿制药申请持有者应对标签按照最新批准的参比制剂的标签进行修订。如果仿制药申请持有者在本指南发布之后被列为参比制剂的,持有者应按照本指南规定的方式进行补充申请。
规范的、可选的标签标准语言描述
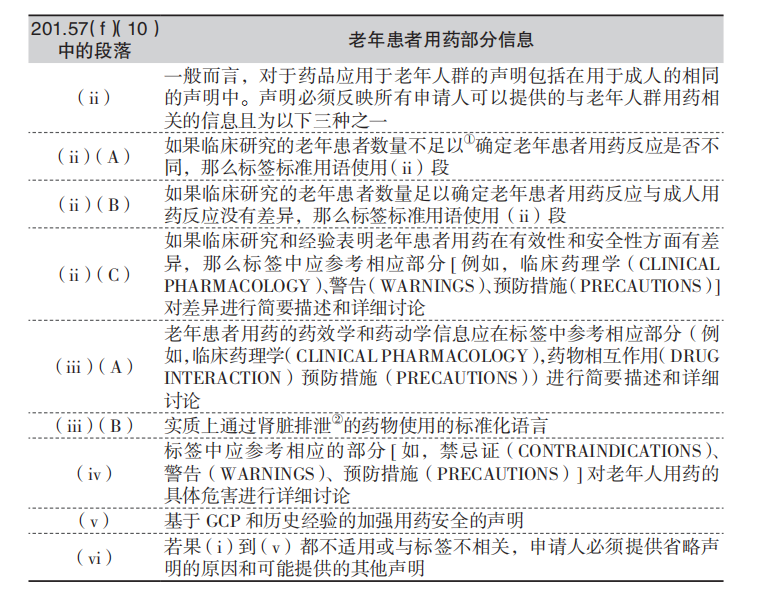
老年患者用药标签规定(§201.57(f)(10))从(i)到(vi)共有6段内容描述。基于可用信息的类型和对这些信息的解释说明,此规定列出了各种可用于标签中老年患者用药部分的描述方式。此外,(ii)(A)、(ii)(B)和(iii)(B)还说明了老年患者用药部分的标准化语言。对老年患者用药标签进行补充申请或修订,应当包括一个封面页以清晰地阐明本次提交的内容是针对于标签中老年患者用药部分的,并要引用法规中与本次修改有关的具体段落。提交的标签可能引用到不止一段的内容。表8-3总结了(i)到(vi)段的要求。
注:①低于100例老年患者(参见62FR45313和45317部分的讨论);②相关规定没有对“实质上通过肾排泄”进行定义(参见62FR45313和45318部分的讨论)。
由于目前还未有包含具体老年患者用药说明的申请被批准,FDA也不提倡申请持有人按照201.57(f)(10)(i)要求提交老年患者用药标签的补充申请。(i)部分是对未来提交的NDA或BLA以及目前正在审理的申请中的具体老年患者用药说明的相关要求。在这两种情况下,不会对申请重新审评,因为老年患者用药标签的相关信息将作为正在审评的NDA或BLA的原始文件或修订文件提交。
在某药品不适用于老年人群的情况下,申请持有人应按照201.57(f)(10)(vi)的规定提交补充申请,以要求删除老年患者用药部分或提出一个类似的可行的要求并说明原因。
法规中关于老年患者用药标签的陈述不适用于大多数局部眼科制剂。一般而言,在有效性和安全性两方面,临床研究还未证实老年患者和青壮年患者对局部眼科制剂的临床反应有所不同。通常,局部眼科制剂系统吸收少,因此系统间相互作用不太可能发生或不常见。当老年患者和青壮年患者临床反应未发现不同时,局部眼科制剂新药申请的申请人应要求按照201.57(f)(10)(vi)的规定对老年患者用药部分做一个相关说明,比如“在药物安全性和有效性方面,未发现此药在老年患者和青壮年患者之间存在差异”。
内容和格式
在1998年2月11日发布的联邦公报中(63FR6854),FDA修订了NDA的格式和内容方面的有关规定,要求NDA中要有不同人口分组,包括年龄分组之间的安全性和有效性数据(21CFR314.50(d)(5)(v)和(vi)(a))。1998年8月10日生效的此法规中,FDA又修订了新药临床研究申请(IND)的相关规定,要求申请人在年度报告中以表格形式汇总药品或生物制品临床研究中不同分组,包括年龄分组参与研究的人数(21CFR312.33(a)(2))。
所有遵照老年患者用药标签最终法规提交的补充申请应在FDA356h表格中“提交原因”一栏中标注“老年患者用药标签补充申请”,将表格提交给CDER和CBER。需要包括在补充申请文件中的信息包括如下内容
附件。附件需包括以下信息。
(1)说明该文件是老年患者用药标签的补充申请。
(2)关于此补充申请引用的具体法规段落。
(3)用户费用支付识别码(如适用)。
(4)如果不需要缴费,解释原因。
详细目录。
修订后的标签。
(1)包括修订后的标签草案。
(2)包括标记过的上一次批准的标签副本,清楚地表明添加和删除部分,用注释标明文件中支持数据的位置。
(3)提交至CBER的文件要采用FDA2567C标签和通知传递表格。
适用的法规段落。
阐明标签修订是参照201.57(f)(10)(i)~(vi)中的某个段落,并解释是怎样应用法规的。
用户费用。
如果适用,那么需要向指定银行提交相应的用户费用。每个提交文件(OMBNo.0910-0297)需包括用户费用封面表单(表格FDA3397)。如果不需要缴纳用户费用,申请人需要在封面表单上说明。
支持老年患者用药标签修订的数据。
应按照数据类型(如有效性、药代动力学/药效动力学、安全性)分别进行阐述、分析和总结,数据包括从已发表文献中获得的数据,并采用“新药申请临床与数据部分的内容和格式”中所描述有关格式(FDA1988年发布)。另外,应包括以下几点内容。
描述信息来源(例如,申请人临床试验数据、医学文献数据、药物监控数据)。
安全性数据应包括药物暴露剂量、暴露时间和不良反应。
仅在已经批准的标签中改变信息位置的,不要求重新分析原始数据来支持该信息。
目前已批准的药品标签中对老年患者用药做任何变更,支持此变更的数据分析和源数据都需要提交。对于某些补充申请,其可能会有大量的相关数据,在这种情况下,通常要联系FDA申请所在部门,讨论应该提交哪些数据。
提交的文件应阐明如何检索医学文献的(例如,《医学索引》),检索的时间范围(年/月~年/月),以及进行检索的日期。需要包含申请人查阅过的所有文献的清单。不需要对每篇文章进行总结,只有那些支持标签变更的文献需要按照“新药申请临床与数据部分的内容和格式”进行总结,并且提交的文件中要包含这些文献的副本。FDA补充申请的审评员可能会要求提供未在文件中提交的但包含在清单中的其他文献。
老年患者用药标签补充申请的用户费用
和1997年FDA修订的现代化法案一样,1992年发布的的处方药用户费用法案,也没有说明老年患者用药标签补充申请用户费用豁免的情形,尽管根据FD&C法案736(d)条款(21U.S.C.379h(d))中列出的一些条款,补充申请可能有费用豁免的资格。然而很少有老年患者用药标签的补充申请需要支付用户费用,因为他们不需要对临床数据进行审批。只有补充申请中的临床数据需要审批时才需支付用户费用。
如果有任何关于资料提交的问题,制造商应该联系相应的审查部门。审查部门将决定老年患者用药标签补充申请中是否需要临床数据。需要临床数据的补充申请通常要承担用户费用,因此,除FD&C法案第736条(a)(1)规定的其他情形,补充申请要么支付用户费用,要么豁免。不需要临床数据的补充申请可考虑申请不支付费用。含有临床数据但不需要经过批准的补充申请,由于补充申请不会修改现有已批准标签中的语句,因此通常不会被要求缴纳用户费用。例如,大多数符合201.57(f)(10)(ii)(A)和(B)情形的补充申请无需支付费用。
对于在警告(WARNINGS)、预防措施(PRECAUTIONS)或禁忌证(CONTRAINDICATIONS)等部分减少或去除某些与老年患者用药相关内容的补充申请应有数据支持。如果这些数据满足需收取用户费用的定义要求那么该补充申请可能要缴纳用户费用。【摘编自《FDA药品与生物制品管理办法指南(二)》,中国医药科技出版社】
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐
-

剖析法条明要素 靶向发力寻证据 ——浅析证明对象在药品行政处罚中的应用
如何运用证明对象的概念指导药品行政执法部门正确收集证据、认定案件事实并准确适用法律呢?笔者认为,可分解法律条文中规定的药品违法行为的构成要件,明确各构成要素,并将这些要素作为证明对... 2025-12-16 08:45 -

企业捐赠的医疗器械质量不合格,如何处罚?
A省药监局查处一起医疗器械生产企业生产的医用外科口罩不符合强制性标准案。该案中,B企业生产的不合格产品一部分用于销售,另有70%的产品捐赠至社会单位。 这并非个案。此类案件争议的焦点集中... 2025-12-16 08:50
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有