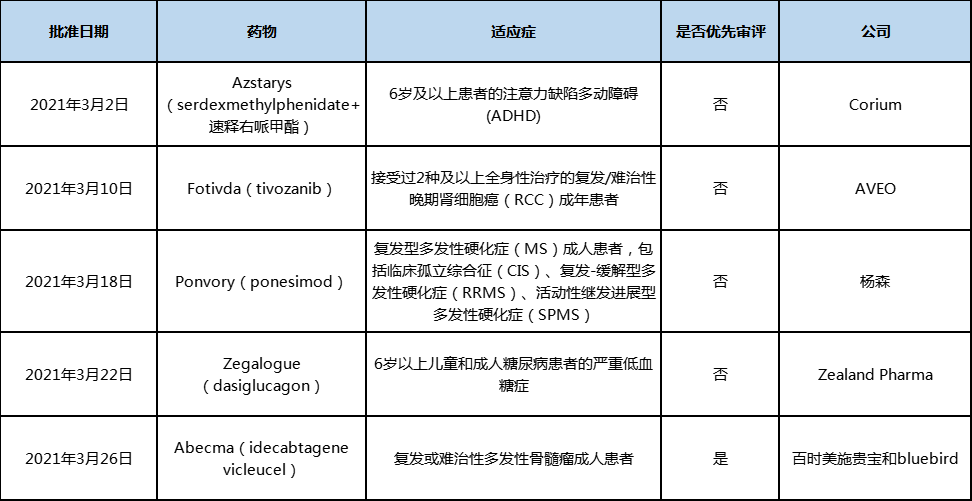
2021年3月中美欧批准上市的新药
- 2021-04-06 14:43
- 作者:陈倩
- 来源:中国食品药品网
2021年3月,美国、欧盟和中国共有12款新药获批,其中Zegalogue、ponesimod和idecabtagene vicleucel为全球首批。
美国
2021年3月,美国FDA批准上市5款新药,包括4款新分子/新生物制剂和1款细胞疗法。
表1:2021年3月美国FDA批准上市的新药
根据Pharmadigger数据库,2021年3月在美国全球首批的新药有Zegalogue、ponesimod和idecabtagene vicleucel。
糖尿病患者出现严重的低血糖症是一种常见疾病,低血糖症的急救主要靠胰高血糖素。Zealand Pharma的可溶性胰高血糖素类似物Zegalogue可以在快速从冻干粉针剂配置后使用,更具便利性和稳定性。
Zegalogue的批准主要是基于在6-17岁儿童的1型糖尿病患者中进行的3项随机、双盲、安慰剂对照的多中心3期研究结果。所有研究的主要疗效终点是血糖水平恢复时间,定义为自给药之日起血糖增加≥20mg/dL,且在45分钟内未进行额外治疗干预。试验结果显示,与安慰剂相比(恢复时间约30分钟),Zegalogue给药后患者血糖的恢复速度更快,平均中位恢复时间仅为10分钟。该试验在成人和儿科患者组研究中都成功达到了主要终点。在另一项3期成人试验中,99%的患者血糖在15分钟内恢复到了正常水平。

图片:Zegalogue关键III期儿童试验结果
杨森的Ponesimod是一款口服选择性鞘氨醇-1-磷酸受体1(S1P1)调节剂,这类药物可抑制S1P蛋白活性,从而减少循环淋巴细胞的数量。髓鞘是隔离神经细胞的保护层,在MS患者中,免疫细胞进入大脑会损害髓磷脂,髓磷脂损伤后会减慢或停止神经传导,产生MS症状。
Ponesimod的批准主要是基于一项关键性头对头临床3期研究OPTIMUM,该研究在全球28个国家162个临床中心开展,共入组1133例RMS成人患者,主要终点是年复发率(ARR)。结果显示,治疗108周后,与赛诺菲的特立氟胺相比,Ponesimod的ARR显著降低30.5%。此外,缓解疲劳的次要终点也得以满足,并且大脑中的合并孤立活动病灶(CUAL)也降低了56%。
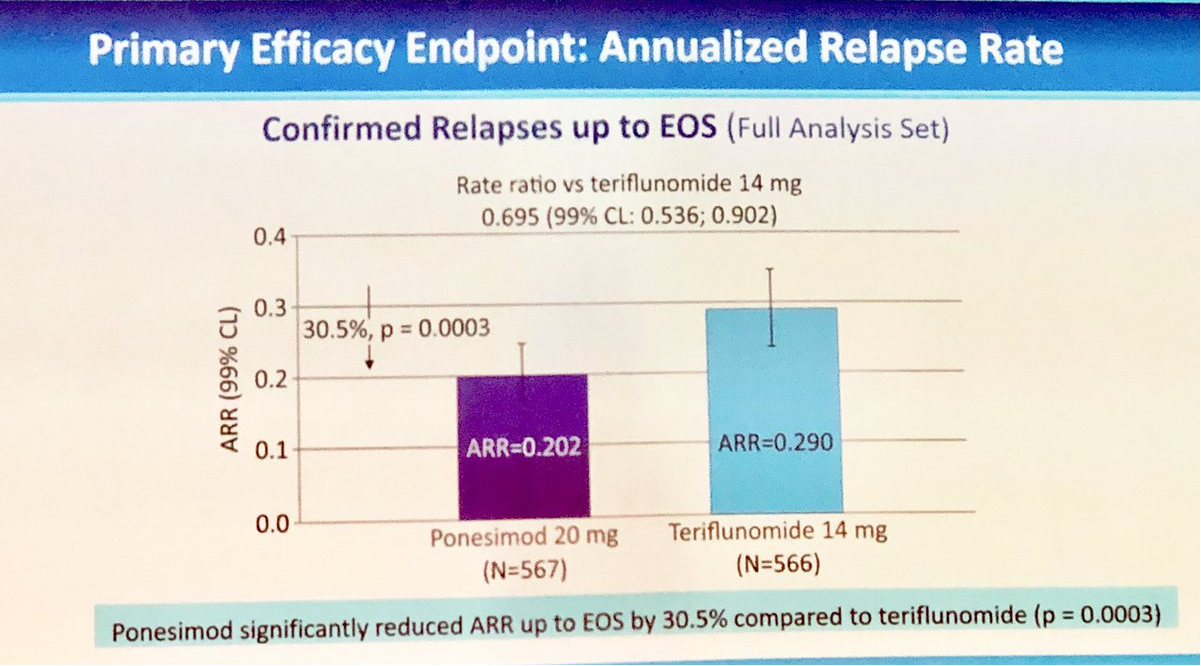
图片:OPTIMUM试验主要终点
2021年3月26日,Abecma(idecabtagene vicleucel)获批上市,用于治疗已经接受过四种以上前期疗法的复发/难治性多发性骨髓瘤(R/R MM)成年患者。这是首款用于治疗MM患者的细胞疗法,也是首款获得批准靶向BCMA的细胞疗法。
该药的批准基于II期KarMMa试验,这项试验囊括了128位此前接受过三种及以上疗法的r/r MM患者数据。在接受一次性注射150、300和460 x 106 CAR阳性T细胞三种剂量治疗后,参与者总缓解率(ORR)为72%,28%的患者实现完全缓解,并且这些实现完全缓解的患者约65%缓解时间持续了至少12个月。ORR也呈剂量相关性,低剂量为50%,高剂量为82%。
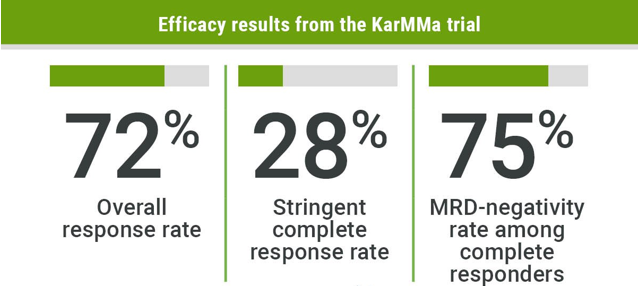
图片:KarMMa试验有效性结果
欧盟
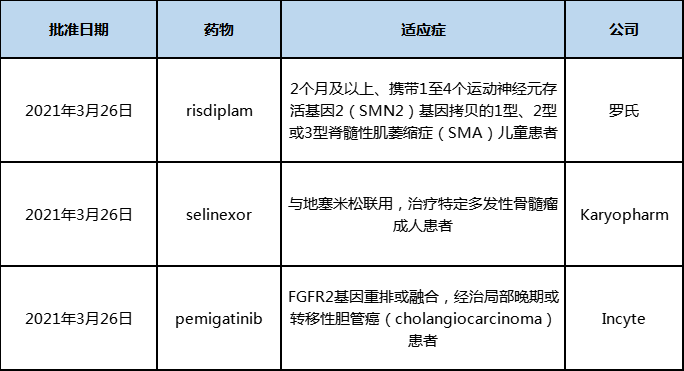
2021年3月份,欧盟共批准3款新药risdiplam、selinexor和pemigatinib,这些药此前都已在美国获批上市。根据Pharmadigger数据库,pemigatinib也在我国由信达生物开始启动III期临床试验,信达生物于2018年12月17日从Incyte获得该产品在中国内地、香港、澳门和台湾地区的临床开发与商业化权益。
表2:2021年3月欧盟批准上市的新药
中国
中国在3月份共批准了4款新药,其中在3月的最后一天同时批准上市了两种针对胃肠道间质瘤的靶向新药——瑞派替尼和阿伐替尼,这两种新药都属于新一代KIT/PDGFRA靶向药,但获批的适应症不同,前者是针对包括任何突变的四线治疗人群,后者是针对携带PDGFRA外显子18突变的晚期人群。
表3:2021年3月中国批准上市的新药
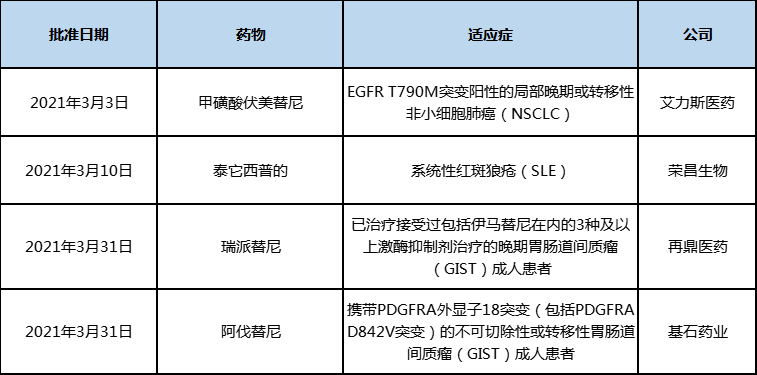
另外两款获批的药物均为国内自主研发的新药,在审评过程中均获得了优先审评审批资格。伏美替尼是艾力斯医药自主研发的第三代EGFR抑制剂,在代号为ALSC003的IIb期多中心单臂研究中,评估了伏美替尼治疗T790M突变NSCLC患者的疗效和安全性。2018年6月至2018年12月期间,共纳入220例患者,其中212例患者为IV期。截至2019年4月12日,患者ORR为73.6%,预估6周和12周DCR率为87.3%和82.3%,中位PFS为7.6个月,中位OS和DoR均未达到。
泰它西普是荣昌生物制药自主研发的靶向BLyS和APRIL的原创性抗体融合蛋白药物,用于治疗系统性红斑狼疮(SLE)和类风湿性关节炎等多种自身免疫疾病。泰它西普于2011年获国家药监局批准临床试验,2019年11月13日在国内申报上市,2019年12月5日以具有明显治疗优势创新药纳入优先审评审批。2020年9月获美国Ⅱ期临床试验(IND)许可。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐