中美欧药品注册对照谈 | 中国eCTD实施的策略研究(下):中美欧eCTD的对比及分析
- 2021-05-14 16:57
- 作者:周芳 杨阳
- 来源:中国食品药品网
中国、美国和欧盟eCTD体系都基于ICH eCTD指导原则建立,基本要求和流程相似,同时与各个国家/地区的法规衔接兼具特色。以下将从技术文件、模块信息、准备和递交流程、适用范围和实施进程四方面进行对比和分析。
eCTD技术文件
eCTD技术文件主要由三大版块组成:ICH指导原则、区域性指导原则和相关配套文件。
目前全球范围内已实施的eCTD基础技术文件为《ICH eCTD技术规范(3.2.2版本)》(Electronic Common Technical Document Specification V3.2.2,简称ICH eCTD技术规范),各个国家/地区的模块二至模块五的技术要求均参照此文件实施。ICH指导原则还包括《eCTD文件格式规范V1.2》《eCTD研究标签文件技术规范》等。国家药品监督管理局药品审评中心(以下简称“CDE”)组织完成了ICH指导原则的翻译工作,并将中文翻译稿作为中国eCTD技术文件的配套文件公开征求意见。
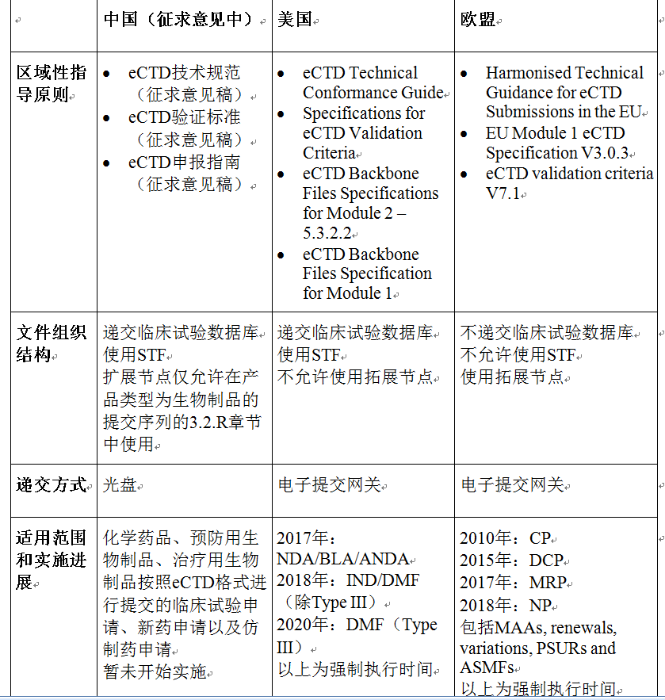
在ICH eCTD指导原则的基础上,根据当地的药品注册相关法规,各国家/地区监管机构均建立了区域性eCTD指导原则体系,体现eCTD具体实施的要求,其中主要包括eCTD技术规范、eCTD申报指南和eCTD验证标准文件等。美国和欧盟还发布了eCTD模块一技术规范文件。中国eCTD模块一的具体技术要求涵盖在《eCTD技术规范(征求意见稿)》(简称中国eCTD技术规范)和《eCTD申报指南(征求意见稿)》(简称中国eCTD申报指南)中。
此外,ICH和各国家/地区也分别发布了相应的配套文件,如ICH文档类型定义(DTD)文件、区域 Schema文件、受控词汇文件、样式文件、定义文件等,以便企业进行系统搭建和流程设计。
eCTD模块信息
一个eCTD新药申请首次申请首次提交的全套申报资料输出文件夹,包括模块一至模块五的内容文件、2个骨架文件(XML文件)、1个存放 DTD相关文件的util文件夹及 1个存放 MD5值的文本文件。对比中国(征求意见稿)、美国和欧盟的模块信息,差异主要体现在模块一以及模块四和模块五中。
ICH eCTD技术规范明确了模块一应包含区域特定的行政文件和药品信息。信封信息是eCTD区域骨架文件的一部分,给电子资料管理系统提供处理和组织申报资料时使用的元数据。
中美欧模块一信封信息对比
模块四和模块五的差异主要体现在以下方面:
一是研究标签文件(STF)。中国与美国均使用STF,而欧盟不允许使用。中国eCTD技术规范(征求意见稿)指出,对于模块四中的4.2.X章节和模块五中的5.3.1.X至5.3.5.X章节,申请人应使用STF的方式进行组织和呈现,临床试验报告也应使用适当的STF文件标签来展现文档的内容。
二是扩展节点。美国不允许使用扩展节点;欧盟允许使用扩展节点;中国eCTD技术规范(征求意见稿)规定,扩展节点仅允许在产品类型为生物制品的提交序列的 3.2.R 章节中使用。
三是临床试验数据库。中国与美国均要求递交临床试验数据库,欧盟则不要求递交。中国eCTD技术规范(征求意见稿)指出,临床研究报告相关的临床试验数据库应在 eCTD 申报资料中一并提交,在骨架文件中应位于相应的临床研究报告之后,并使用适当的 STF 标签进行标识。
eCTD准备和递交流程
申请人确定按照eCTD进行注册申报后,其后续流程可以概括为文件撰写、文档出版和验证、递交和存档。中国、美国和欧盟在流程上的差异主要体现在文件撰写和递交步骤上。
文件撰写方面的差异主要来自于中国eCTD对语言的特殊要求。中国eCTD申报指南(征求意见稿)明确要求,申请人提交的全部申报资料应当使用中文并附原文,其他文种的资料可附后作为参考。《ICH eCTD 文件格式规范V1.2》为创建用于 eCTD提交的PDF文件提出了建议,中美欧均参照此文件进行撰写。除此之外,中国eCTD技术规范(征求意见稿)提供了针对中文申报资料的要求,包括字体、字号和字体颜色等。对于在多个国家/地区进行申报的注册申请,考虑到中国对申报资料语言的要求,建议在建立eCTD申报系统和流程,以及设计申报策略和递交时限时,对文件管理进行充分考虑。
对于递交方式,中国eCTD技术规范(征求意见稿)中明确指出,申请人准备的eCTD申报资料需通过物理电子媒介提交。目前只接受一次写入型光盘作为存储介质,包括CD-R、DVD+R、DVD-R这三类。相信后续随着eCTD全面实施,CDE将加快推进电子提交网关建设,实现申报资料的网上提交。美国早在2006年开始使用电子提交网关(Electronic Submissions Gateway,ESG),目前要求所有小于等于10G的eCTD都通过ESG递交。欧盟于2012年上线了适用于CP申请的电子提交网关(eSubmission Getaway),并从2014年3月1日起强制要求所有eCTD格式的CP申请通过电子提交网关进行递交;对于MRP、DCP和NP,申请人可以使用欧洲通用提交平台(Common European Submission Portal,CESP)。美国和欧盟的电子提交网关通道都有系统版(Applicability Statement 2,AS2,Gateway to Gateway)和网页版(FDA WebTrader / EMA eSubmission Web Client)两种方式,申请人可以结合自身情况选择合适的方式。
适用范围和实施进程
中国eCTD申报指南(征求意见稿)指出,本指南适用于化学药品、预防用生物制品、治疗用生物制品按照eCTD格式进行提交的临床试验申请、新药申请以及仿制药申请。目前开始实施时间待定。
美国从2003年开始试行接收eCTD,2007年开始正式接受eCTD。此后经过长达10年的过渡期,2017年开始针对部分递交类型强制要求eCTD。从2020年起已全面强制要求按照eCTD递交,强制执行的类型包括NDA、BLA、ANDA、IND和DMF。
欧盟于2002年与美国几乎同步开始启动eCTD建设,其发展速度相对美国较快,2005年开始了集中审批程序的全面实施,此后经过5年过渡期在2010年强制要求集中审批程序以eCTD格式递交。从2018年起,欧盟已强制要求所有药品上市注册审评程序都以eCTD格式递交,包括CP、MRP、DCP和NP。
结合美国和欧盟的实施进程经验,可以预见,中国eCTD的实施进程也将是循序渐进的。中国eCTD申报指南(征求意见稿)提出,在eCTD实施初期,原纸质递交和电子提交将并行,申请人根据实际情况选择合适的方式,后续将全面实施eCTD。
值得注意的是,当一个申请首次以eCTD进行递交后,为了实现注册文档生命周期的管理,申请人在后续序列申请中不能再使用纸质递交。eCTD申报指南(征求意见稿)指出,申请人使用eCTD提交申报资料后,针对此药品的所有后续提交,包括补正回复、发补回复、补充申请等,都应使用eCTD进行提交,不得再使用原纸质方式进行递交。
中美欧eCTD对比
小结
纵览中国eCTD技术文件征求意见稿,既与我国注册法规紧密衔接,也与国际标准充分接轨,在技术文件结构和内容方面均体现了全面性、一致性和前瞻性。
与目前的纸质递交相比,eCTD是一种全新的申报模式,在提高申报和审评效率的同时,也将带来挑战,如:申请人需制定适宜的eCTD递交策略,制定端到端的递交流程,梳理文件准备和质量控制流程,确保文件符合eReadiness要求。从2015年CDE启动eCTD研究和建设工作,到能够最终实现从纸质递交至eCTD递交的整体过渡,是申请人和监管机构共同思考和努力的方向。
2021年5月10日,《国务院办公厅关于全面加强药品监管能力建设的实施意见》发布,再次提出“提升‘互联网+药品监管’应用服务水平”“建立健全药品注册电子通用技术文档系统,推进审评审批和证照管理数字化、网络化”。随着相关政策法规的完善,以及国际趋同化的注册申报标准和电子信息技术的迅猛发展,期待eCTD尽快在中国开启实施步伐,相信eCTD的实施将进一步推动药品注册的全流程电子化管理,提高药品全球同步申报和审评审批的效率。(和铂医药注册事务总监 周芳,思路迪医药产品线管理副经理 杨阳,作者均为DIA中国法规事务社区核心成员。辉瑞中国区药品注册文件出版中心负责人吉申齐、上海盛迪医药(恒瑞集团)注册部高级注册经理王芳对此文亦有贡献。)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐