中美欧药品注册对照谈 | 中国eCTD实施的策略研究(上):概览及发展历程
- 2021-05-14 16:57
- 作者:周芳 杨阳
- 来源:中国食品药品网
2015年,《国务院关于改革药品医疗器械审评审批制度的意见》发布,国家药品监督管理局药品审评中心(以下简称“CDE”)全面启动了eCTD研究和建设工作。随着2020年《药品注册管理办法》和相关配套法规的正式发布,CDE对eCTD技术规范等征求意见稿进行了相应修改和完善,如调整注册行为类型、扩展节点和研究标签文件(STF)的使用要求等。
本文旨在研究eCTD在中国的实施策略,主要通过ICH eCTD概览、中国eCTD发展历程、以及中美欧eCTD的对比及分析等方面进行了研究和梳理。
什么是 ICH eCTD?
eCTD(electronic Common Technical Document,电子通用技术文档)是ICH多学科系列的指导原则,编号M8。eCTD是用于药品注册申报和审评的电子注册文档,通过可扩展标记语言,(Extensible Markup Language,XML)将符合CTD规范的药品申报资料以电子化形式进行组织、传输和呈现。
为统一药品申报资料格式的电子递交要求,ICH于2003年发布第一版eCTD技术规范(v3.0),作为ICH成员,美国、欧盟和日本首先开始接受eCTD申报。2008年,ICH发布v3.2.2版本的eCTD技术规范,这是目前eCTD实施国家(地区)正在执行的版本。2015年,为进一步提高信息的稳健性、灵活性和稳定性,ICH发布了eCTD v4.0版本,目前欧美日等国家和地区正在探索试点和计划实施的过程中。
eCTD自2003年开始实施以来,已逐渐成为一种具有先进技术优势的审评方式,目前3.2.2版本已在美国、欧盟、日本、加拿大、南非、海湾地区、澳大利亚、泰国等40余个国家和地区广泛应用,新加坡、韩国、中国等均在实施过程中。
经过全球各个国家和地区十几年的实践积累,eCTD的实施已证明在药品注册文件的创建、传输、审评、存档、检索、再利用、生命周期管理等方面,对监管机构和工业界都带来了便利,大大提高了全球范围内注册递交和监管审评的效率。与传统的递交方式相比,eCTD更便捷、更环保、更安全。“e”不仅代表文档电子化,还代表结构电子化、递交电子化和审阅电子化。通过规范申报资料的标准并对申请进行验证,eCTD对文件质量提出了更高要求。通过对注册文件赋予生命周期,使注册申报与产品开发的生命周期保持同步,提高申报资料的完整性和合规性。FDA 国际事务局局长Justina A. Molzon博士曾在ICH成立20周年时表示,“eCTD已被证实对提高申报效率和审评效率发挥了至关重要的作用。除以更快捷的方式将申报材料递送给审评人员之外,eCTD格式为各审评学科建立标准的审评人员电子模板和审评工具提供了便捷”。
中国eCTD的发展历程
ICH CTD是eCTD实施的基础,自2010年9月CDE发布《关于按照CTD格式撰写化学药品注册申报资料有关事项的通知》,中国就开启了CTD格式递交的历程。2016年发布的《化学药品新注册分类申报资料要求(试行)》中对资料的要求与CTD类似,并允许注册分类5类的药品可以报送全套CTD资料。随后,按照2018年国家药监局发布关于适用ICH 二级指导原则的公告要求,化学药品1类、5.1类,治疗和预防用生物制品1类上市申请适用CTD。随着《药品注册管理办法》的发布和实施,2020年国家药监局发布了《化学药品注册分类及申报资料要求》和《生物制品注册分类及申报资料要求》,要求治疗和预防用生物制品、化学药品的临床试验和上市注册申请按照CTD格式提交申报资料,自2020年10月1日起实施。CTD格式在临床和上市注册申请中的全面实施,为eCTD的实施打下了坚实的基础。
随着药审改革的深入推进,CDE开始全面开展eCTD系统建设工作。2017年国家药品监管部门加入ICH,进一步加快了eCTD的建设和实施进程。2019年以来,CDE多次发布eCTD相关技术文件征求意见稿,并组织相关流程和系统测试,确保为eCTD在中国的正式实施积累充分且必要的经验。
中国CTD/eCTD发展的主要事件
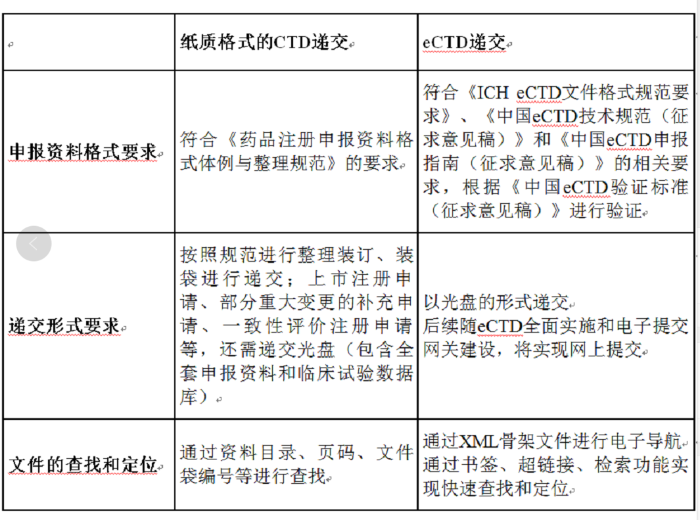
从CDE已发布的eCTD技术文件征求意见稿可以看出,eCTD递交在申报资料要求、递交形式、文件查找和定位等方面与目前的纸质递交有明显不同。申请人需全面理解eCTD技术要求,根据实际情况,制定适宜的eCTD实施计划,CDE在eCTD申报指南(征求意见稿)中也对从纸质递交向eCTD电子提交过渡的考量提供了建议。
中国纸质递交和eCTD递交的比较
(和铂医药注册事务总监 周芳,思路迪医药产品线管理副经理 杨阳,作者均为DIA中国法规事务社区核心成员。辉瑞中国区药品注册文件出版中心负责人吉申齐、上海盛迪医药(恒瑞集团)注册部高级注册经理王芳对此文亦有贡献。)
本文仅代表作者观点,不代表本站立场。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐