全球肿瘤药物市场回顾与趋势展望(上)
- 2021-09-14 16:30
- 作者:艾昆玮
- 来源:
2020年尽管新冠肺炎疫情对医疗健康行业产生了重大影响,肿瘤领域临床研究、新疗法产品管线均取得不俗进展。本文回顾了2020年全球肿瘤药的研发、上市、药物使用、药物支出等情况,并对未来五年的肿瘤市场前景、药物支出等进行了预测。
丰富的创新药物
2010年以来获批上市的肿瘤新药数量激增,2020年延续了这一趋势,美国共有17个肿瘤新药和3个肿瘤诊断试剂获批上市,其中16种被授予孤儿药资格。过去五年,有62种创新疗法在美国上市,获批用于治疗24个瘤种的130个适应症。而且,越来越多机制首创(first-in-class)的新药获得加速审批资格或突破性疗法认定,基于I期或II期临床试验结果有条件快速获批上市。全球范围内肿瘤新药的上市情况各不相同:2016-2020年中国批准了37种肿瘤新药,高于2011-2015年的6种;2016-2020年,欧盟4国+英国和美国分别批准了53种和62种肿瘤新药。未来五年,全球将有近100个肿瘤新药上市,聚焦罕见肿瘤领域的药物占比将近50%。
2020年美国共有17个肿瘤新药和3个肿瘤诊断试剂获批

图1:2020年在美国上市的肿瘤新活性物质
2020年美国上市的新药在适应症和机制上取得一系列显著的进展:有17种新活性物质(NAS)被授予孤儿药资格,包括16种癌症药物和1种罕见神经内分泌肿瘤诊断试剂;15个基于I/II期临床试验获批,与现行标准治疗相比,有更好的疗效,或鲜有治疗方案,是获批关键;基于I/II期和II期临床试验批准的药物,关键研究终点是缓解率和改善无进展生存期(PFS),尤其是治疗选择有限的晚期癌症;小分子激酶抑制剂显著提高缓解率、改善无进展生存期(PFS);2020年上市了5个First-in-class分子,包括用于前列腺癌的新型显像剂、用于神经纤维瘤的新型小分子激酶抑制剂selumetinib、用于多发性骨髓瘤的新型BCMA抗体belantamabmafodotin、用于上皮瘤的tazemetostat和用于弥漫性大B细胞淋巴瘤的tafasitamab,均具有显著的临床获益;20个上市的肿瘤或诊断产品中,13个基于单次试验获得批准,因其在试验中表现出显著的临床获益获得FDA批准。
2016-2020年,全球共上市64种肿瘤新活性物质,2001-2020年合计161种
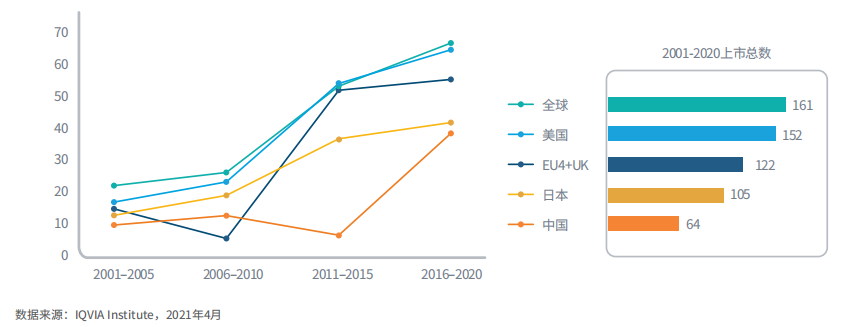
图2:全球和部分国家上市的肿瘤新活性物质数量
2020年全球共上市18种肿瘤新活性物质,五年总量达到64种。
2016-2020年,美国上市了62个NAS,而EU4+英国为53个,日本为40个,中国为37个。在中国和日本,药品的上市时间通常不与全球同步,两国与全球首发新药的上市时滞较长。
未来五年,在肿瘤领域预计全球将有近100个NAS上市,聚焦罕见肿瘤领域的药物占比将近50%,意味着每个新药物对应的适应症数量更少。同时,也会有一些具有多个适应症的广谱药物,通常基于基因组学检测(PGx)结果,而与组织无关,预计这些情况将日益普遍。
研发管线充盈
2020年,研发管线中的候选药物数量约为3500个,相比2015年增长了75%,这表明肿瘤领域未被满足的临床需求仍然较大。2020年启动的肿瘤相关临床试验大约有1600个,创历史新高。肿瘤药从I期临床试验到监管提交阶段的综合成功率,从2010年的约10%提高到2020年的15.8%;罕见肿瘤药的综合成功率为32.9%,是普通肿瘤药的5-6倍。2020年,由于针对罕见肿瘤的II期临床研究的临床开发生产力急剧增加,肿瘤临床开发生产力(成功率、临床试验复杂性和试验持续时间的综合指标)有所改善,但总体开发生产力水平仍显著低于其他疾病。
处于前期管线的产品数量大约为1000种,相比2016年增长了43%,主要为包括基因编辑、CAR-T和RNA疗法在内的新一代生物疗法。约80%的肿瘤前期研发管线和三分之二的后期研发管线来自新兴生物制药公司,这些公司每年的研发支出不到2亿美元。2010-2020年,肿瘤前期研发管线中,总部位于中国的公司占比从3%上升至18%。
肿瘤后期管线产品(包括新一代疗法和靶向治疗)中,一半针对罕见肿瘤
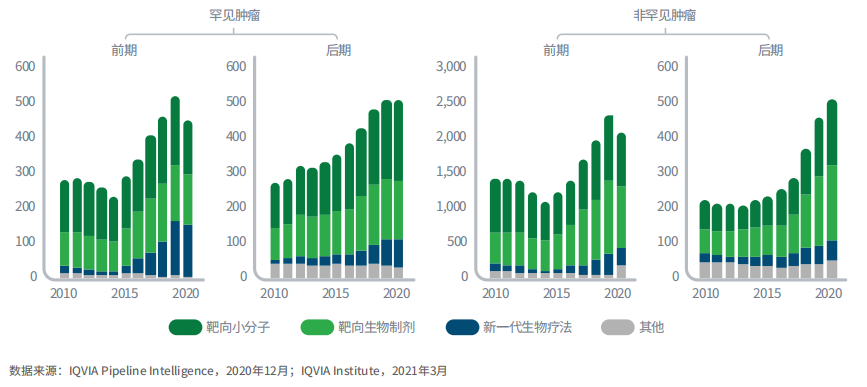
图3:2010-2020年不同类型的肿瘤前期和后期管线产品数量
2020年研发管线中的候选药物达3500个,相比2015年增长了75%,这表明肿瘤领域未被满足的临床需求仍然较大。
2020年,约有500个产品处于罕见肿瘤的后期研发管线,与非罕见肿瘤后期研发管线的数量相当。罕见肿瘤在前期和后期的管线产品数量也相当,未来罕见病疗法可能持续问世。罕见肿瘤药物的综合成功率为33%,其中前期管线中很多候选药有望进入后期研发阶段,并基于加速审批而获批上市。
靶向小分子和生物制剂包括肿瘤免疫疗法、检查点抑制剂、激酶抑制剂以及基于生物标志物的疗法等。新一代生物疗法(包括细胞和基因治疗、基因编辑和RNAi疗法)也是肿瘤领域研究热点,尽管目前为止只有少数疗法上市,但有望实现精准治疗、获得显著疗效。
2020年肿瘤临床试验启动量创历史新高,比2015年增长了60%,主要集中在罕见肿瘤领域
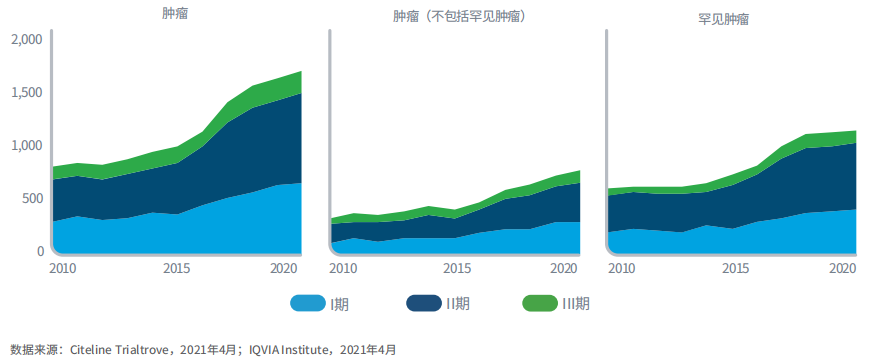
图4:2010-2020年启动的临床试验
肿瘤和罕见病是临床试验中最大的两个领域,两者受疫情的影响程度都低于其他领域。
2020年启动的肿瘤临床试验达到历史高位,比2015年增长60%,体现了该领域的强劲势头。肿瘤和罕见病之间有较大重合,2020年罕见肿瘤临床试验占肿瘤临床试验的63%,占罕见病临床试验的64%。
罕见肿瘤临床试验的综合成功率是普通肿瘤临床试验的6倍
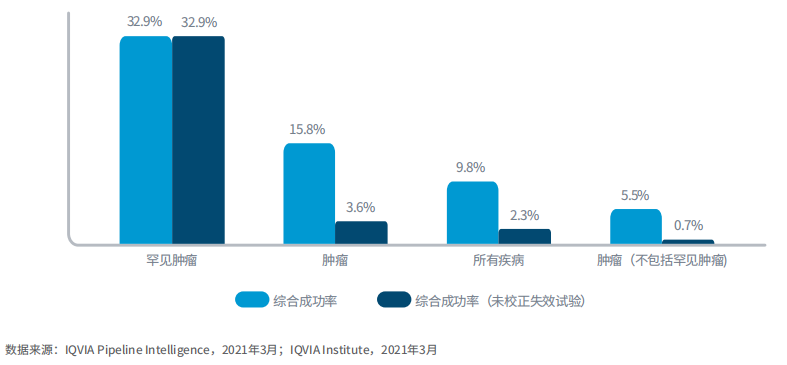
图5:2020年不同治疗领域的药物综合成功率
2020年,临床试验、会议和公司活动受一系列因素干扰,可能会导致试验进展报告异常或暂时减少。这些影响导致试验状态显示为失效,或显示为活跃但三年未有进展报告。因此,含阴性结果在内的综合成功率历史平均值与仅考虑阳性结果的综合成功率之间相差悬殊。
2020年,罕见肿瘤药占整个产品管线的63%,综合成功率为32.9%。其余的肿瘤管线在没有校正失效试验的情况下综合成功率仅为0.7%,校正失效试验后成功率为5.5%。
肿瘤前期研发管线中包括大量被看好的精准疗法
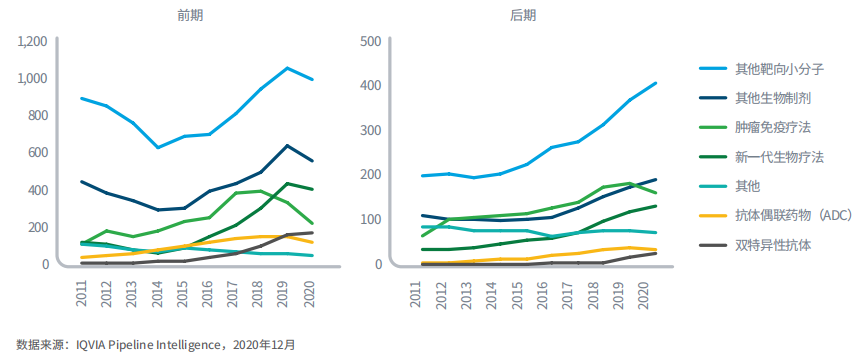
图6:2011-2020年不同类型的肿瘤产品管线
图表说明:其他包括细胞毒性、激素和放疗药物。
肿瘤研究的最大领域是针对数十个靶点的小分子靶向药,这些产品有望持续获批上市,口服给药将给患者带来更多获益。
这些研究在曾经被认为无法攻克的领域取得进展,例如KRAS突变,该突变以前被认为“无药可医”,但在2021年5月,治疗KRAS G12C突变肺癌的sotorasib(Lumakras)获批,为肺癌患者带来治疗新选择。
在过去五年,肿瘤免疫治疗发展迅猛,一系列PD-1/PD-L1抑制剂和CTLA-4抑制剂上市,60种靶向免疫系统(扩增或抑制)的产品市场前景也被看好。
新一代生物疗法日益受到关注,因其在一些患者中表现出极高的缓解率和应答率。
联合疗法也是研发方向之一,如将抗体靶向药物与强效化疗药物连接得到的抗体偶联药物(ADC)。近年来上市了一些ADC,主要用于治疗乳腺癌。
另一种联合疗法双特异性抗体,例如最近获批治疗非小细胞肺癌的amivantamab(Rybrevant),两个抗体分别与癌细胞和免疫细胞结合,靶向杀死癌细胞。
新兴生物制药公司占约80%的前期研发管线,但大型制药公司在ADC和BiTE开发中占据高份额
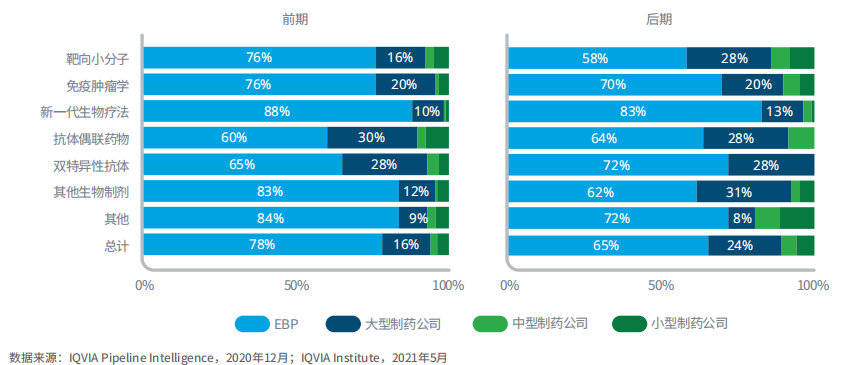
图7:2020年按产品类型和公司类型划分的肿瘤产品管线
图表说明:前期管线产品包括处于发现期、临床前和临床I期的在研产品。后期产品管线定义为处于临床II期至注册的产品。如果多家公司共同参与一个项目,优先考虑占据份额最高的公司。由于四舍五入,百分比总和可能不等于100%。基于销售额对公司进行划分:大型公司:销售额>100亿美元;中型公司:销售额为50亿-100亿美元;小型公司:销售额为5亿-50亿美元;新兴生物制药公司:销售额<5亿美元或研发支出<2亿美元。
小分子靶向产品包括数十种机制,是管线中最大的领域,多由较小的新兴生物制药公司主导。
大多数情况下,大公司占据的份额在后期会有所上升,原因在于,II期临床试验后大公司会通过合并、收购和合作等方式涉足该领域。
在上述分析中,各类公司之间可能会共同开发、合作产品,或获得许可,产品管线划分给拥有最大份额的公司,并不表示这些公司拥有产品所有权或财务权益。
值得注意的是,大公司在早期双特异性T细胞受体(BITEs)的早期开发中占有更大的份额,这很可能是未来几年会持续受到关注的领域。大公司在抗体偶联药物早期研发管线中具有更大的份额,可能因为组合药物中往往涉及大型制药公司已经上市的抗体药物。
2020年,新兴生物制药公司占肿瘤后期产品管线的三分之二
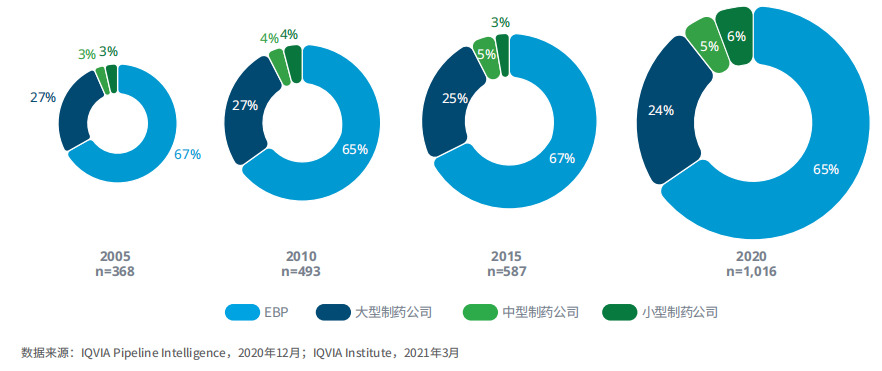
图8:不同公司的肿瘤后期产品管线分布
2005-2020年,新兴生物制药公司占据肿瘤后期产品管线的份额一直稳定在65%-67%。同期,大型制药公司所占份额在24%-27%之间,尽管药物的绝对数量从2005年的98个增加到2020年的243个。
全球有超过600家的新兴生物制药公司及15家大型制药公司正在积极开展肿瘤研究项目。与2015年相比,2020年新兴生物制药公司拥有的后期研发管线的份额下降了2个百分点,这主要是由于一些公司受疫情影响,导致研究项目中断。
前期研发管线中,总部位于中国的公司所占份额已从2010年的3%上升至18%
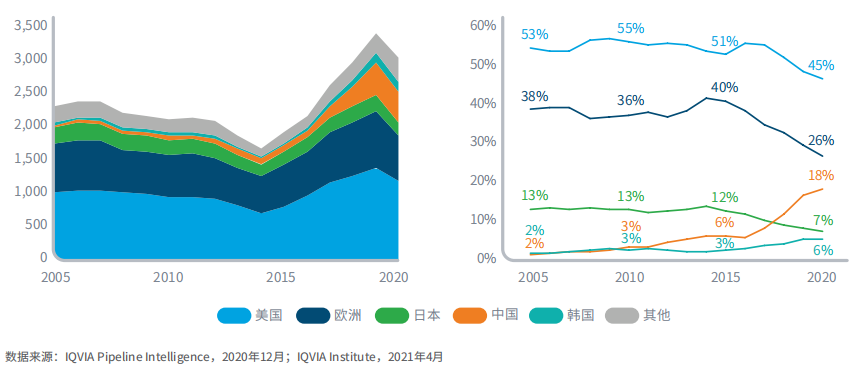
图9:2005-2020年肿瘤前期产品管线的数量和占比
2005-2015年,美国在全球肿瘤前期研发管线的占比保持相对稳定,但在2015-2020年逐渐下滑至45%。
2015-2020年,欧洲占据全球前期管线的份额从40%下降到26%,进行中项目的绝对数量增加了56个,即从583个增加到639个。
总部位于中国的公司的产品占前期研发管线的18%,高于2015年的6%和2005年的2%。
目前,韩国公司占据全球前期产品管线的6%,高于2015年的3%和2005年的2%。
总部位于日本的公司在前期研发管线中所占份额下降,2020年降至7%,低于2015年的12%和2005年的13%。
总部位于中国的公司正在开发的新一代生物疗法占全球的13%
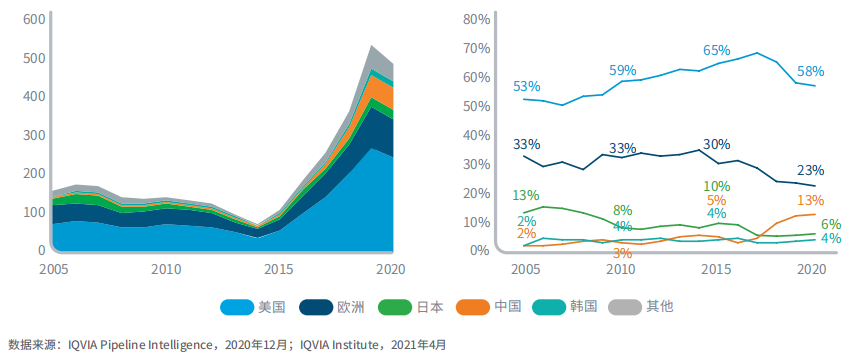
图10:2005-2020年肿瘤新一代生物疗法前期产品管线的数量和占比
2017年之前,美国在肿瘤新一代生物疗法前期产品管线中的占比不断上升,2017年达到顶峰69%,但此后下降了11%;同年中国份额上升了10%,达到13%。
2015-2020年,欧洲占据肿瘤新一代生物疗法前期管线的份额从30%下降到23%,进行中项目的绝对数量增加了66个,即从26个增加到92个。总部位于中国的公司占据肿瘤新一代生物疗法前期产品管线的13%,高于2015年的5%和2005年的2%。总部位于日本的公司占据前期产品管线的份额下降,2020年为6%,低于2015年的10%和2005年的13%。韩国占前期产品管线的4%,与5年前相比没有变化,相比2005年的2%有所上升。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐












