人类遗传资源管理发展历程
- 2021-11-19 10:40
- 作者:张西豫 丁 红
- 来源:中国食品药品网
编者按
人类遗传资源是公众健康和生命安全的战略性、基础性资源,也是疾病转化医学研究、精准医疗战略实施、创新药械研发的基石。为了有效保护和合理利用我国人类遗传资源,维护公众健康、国家安全和社会公共利益,我国对于人类遗传资源的管理逐步加强。2019年6月,国务院发布《中华人民共和国人类遗传资源管理条例》,划定了涉及人类遗传资源活动的五条红线:采集、保藏、利用、对外提供我国人类遗传资源,不得危害我国公众健康、国家安全和社会公共利益;应当符合伦理原则,并按照国家有关规定进行伦理审查;应当尊重人类遗传资源提供者的隐私,取得其事先知情同意,并保护其合法权益;禁止买卖人类遗传资源;外国组织、个人及其设立或者实际控制的机构不得在我国境内采集、保藏我国人类遗传资源,不得向境外提供我国人类遗传资源。
生物医药企业需遵守人类遗传资源活动的五条红线,充分优化人类遗传资源治理结构,以应对我国监管环境的持续变化。
人类遗传资源管理前世今生
人类遗传资源是重要的战略资源,我国是多民族的人口大国,具有独特的人类遗传资源优势。上世纪八十年代前,我国对于人类遗传资源的保护意识和措施都较薄弱,因此存在较大程度的遗传资源流失现象。但随着遗传学的发展,遗传资源的重要性也逐步得到重视,我国著名遗传学家谈家桢先生1997年书信给中央,呼吁保护我国的基因资源,从而成功推动了1998年国家人类基因组北方中心和南方中心正式成立,我国也很快于1998年6月10日出台了《人类遗传资源管理暂行办法》(以下简称《暂行办法》),并由此开启了我国人类遗传资源管理的先河。
随着首部关于人类遗传资源管理的《暂行办法》颁布,在近20多年间,我国对于遗传资源的监管得以快速提高和加强,随着监管实施经验的积累,监管流程也在持续进行优化。
管理历史沿革
1998年6月,《人类遗传资源管理暂行办法》的实施,拉开了中国人类遗传资源管理的序幕。次年1月份,即开始受理人类遗传资源国际合作项目的审批,也包含材料出境审批。
2015年10月,为加强人类遗传资源管理,保障我国人类遗传资源安全,科技部对原人类遗传资源行政许可进行了规范和完善,开始实施新的“人类遗传资源采集、收集、买卖、出口、出境行政许可”。
2017年12月,科技部针对为获得相关药品和医疗器械在我国上市许可,利用我国人类遗传资源开展国际合作临床试验的审批流程进行优化。
2019年7月,《中华人民共和国人类遗传资源管理条例》正式实施,开启了中国人类遗传资源规范化管理的时代。其中规定设立有4个审批(采集、保藏、国际合作研究和材料出境),2个备案(国际合作临床试验、信息对外),以及1个申报登记(重要遗传家系和特定地区人类遗传资源)管理制度。
2021年3月和2021年4月,《中华人民共和国刑法修正案(十一)》和《中华人民共和国生物安全法》相继实施,进一步提升了我国人类遗传资源管理相关法律位阶。
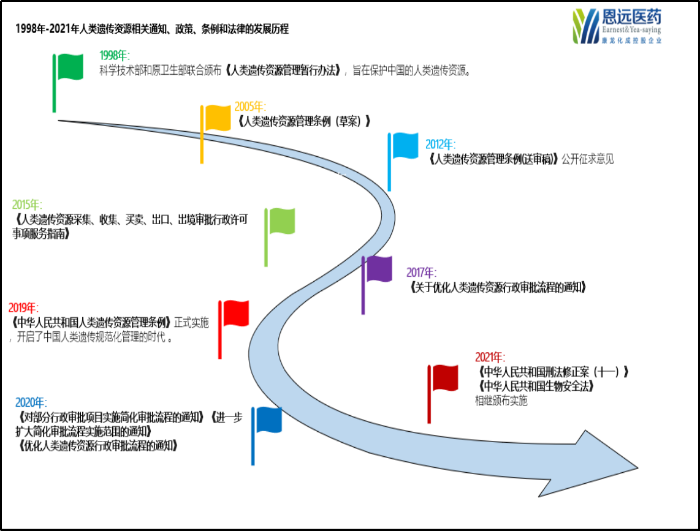
图 1998年来人类遗传资源管理发展路线
人类遗传资源管理划定“警戒线”
从法律规范的角度而言,从1998年制定的《人类遗传资源管理暂行办法》到2019年开始实施的《人类遗传资源管理条例》,再到2020年公布实施的《中华人民共和国刑法修正案(十一)》《中华人民共和国生物安全法》以及2021年出台的《中华人民共和国个人信息保护法》,都对人类遗传资源的保护和合理利用进行了规制。
其中,《人类遗传资源管理条例》对人类遗传资源管理给出了明确的规范,从保护公共利益、尊重隐私、尊重伦理、禁止买卖、禁止非法外流等方面画出了五条“警戒线”。

人类遗传资源作为一种重要的战略资源,对认识生命本质、探索疾病发生发展的原理和机制、研发疾病预防干预策略、促进人口健康具有重要意义。人类遗传资源是“生命说明书”,需要各界一起努力,共同把人类遗传资源保护好、利用好。(作者单位:恩远医药科技(北京)有限公司)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐












