人类遗传资源申报流程概述
- 2021-11-23 09:45
- 作者:孟思雯 丁红
- 来源:中国食品药品网
2019年6月,国务院发布《中华人民共和国人类遗传资源管理条例》,开启了“有效保护和合理利用我国人类遗传资源,维护公众健康、国家安全和社会公共利益”新篇章,对“采集、保藏、利用和对外提供我国人类遗传资源”的范围和流程做出了明确的规定。
在科技部政务平台上,人类遗传资源管理申请分为以下七个类别:
中国人类遗传资源采集审批;
中国人类遗传资源保藏审批;
中国人类遗传资源国际合作科学研究审批;
中国人类遗传资源出境审批;
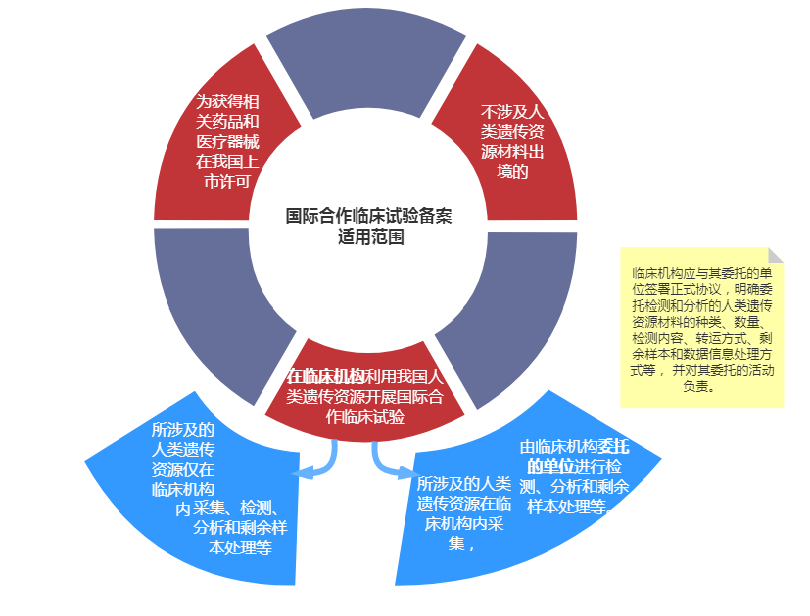
中国人类遗传资源国际合作临床试验备案;
中国人类遗传资源信息对外提供或开放使用备案;
科学技术部重要遗传家系和特定地区人类遗传资源申报登记。
七个类别中包含四类审批、二类备案和一类登记。
四类审批流程基本相同,但保藏审批需要现场勘查。对于提交审批的申请人,除了国际合作科研审批的申请人可以有外方单位,其他三类审批的申请人都需是中方单位。
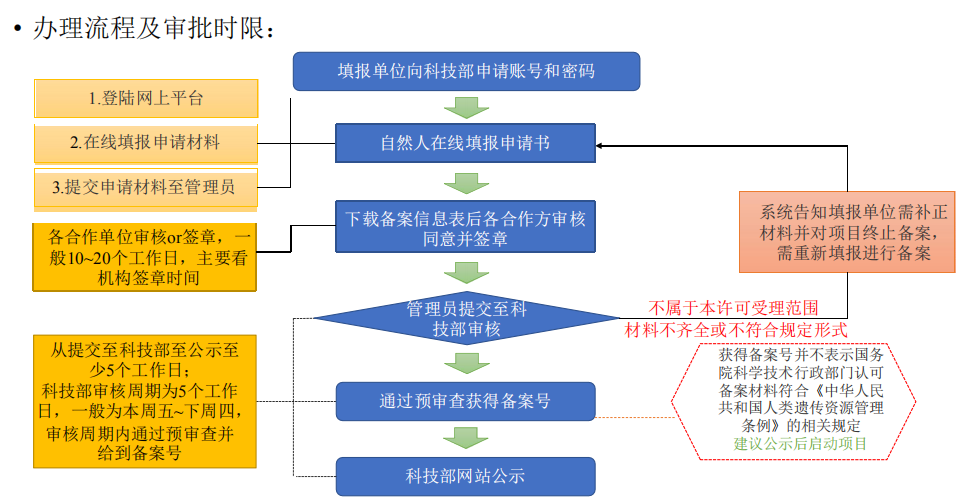
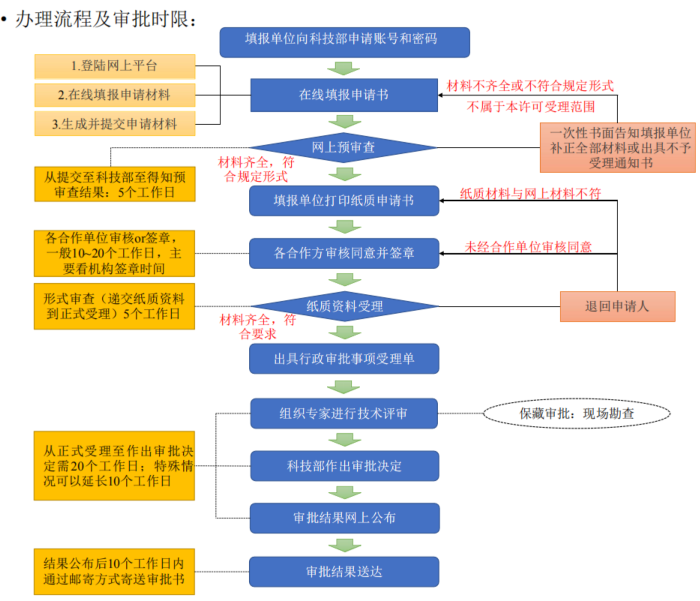
审批流程及审批时限如下:
相较于审批流程,备案流程比较简单,可以全部通过网上提交,无需提供纸质版文件。
备案流程及审批时限如下:
无论是审批还是备案,两者都有公示环节,在科技部网站查询到结果后,才可以开展试验。审批会有审批决定书,备案则没有。
国际合作审批的形式审查至正式受理会提供受理单,告知具体审查的批次;一般需要在行政许可审批会议时间前14个自然日(16:00前签收)将纸质材料递交到中国人类遗传资源管理办公室;如若涉及材料出境审批,可与其一同申报,之后材料出境审批走简化流程审批。
在一项人类遗传资源管理申请中到底是报审批还是备案呢?首先需要看国际合作的确认:国际合作是指各合作方之中(申办者、CRO、医疗机构、第三方实验室等)有任何一方涉及外资背景,则需申报国际合作。其次,确定国际合作的科学研究审批和临床试验备案的依据是:人类遗传资源采集、检测、分析和剩余样本处理等的主体责任人。主体责任人符合临床试验备案“在临床机构”的条件时,按照临床试验备案申请;不符合此条件的,则需要执行科学研究审批流程。
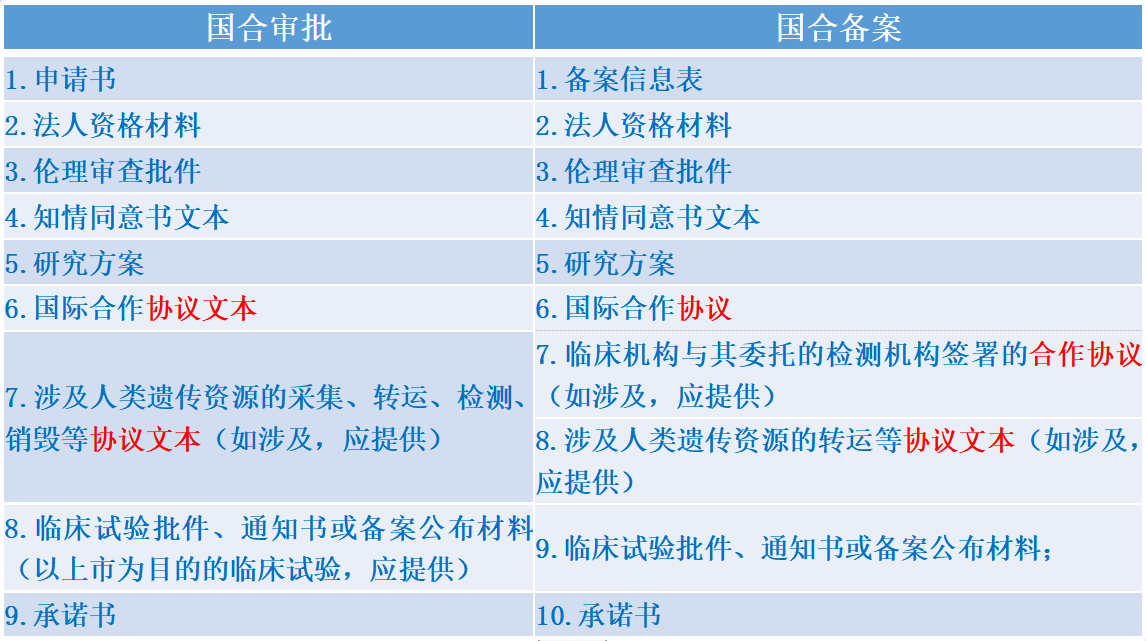
由于科学研究审批和临床试验备案条件不同,二者在遗传资源管理申请时提交的材料也不尽相同,对比如下表:
从上述对比可以看到,国际合作科研审批中协议仅要求文本,无需签字盖章;而备案的要求中除了伦理批件,相关协议要求的是盖章签字,因此申请备案需要在完成协议签署后。省级及以上行政部门的备案,如果是以上市为目的的项目,也需要完成备案后在遗传办提交申请。
执行审批简化流程的,网上预审无需上传伦理批件(但需要提供伦理审查受理文件),在形式审查时递交纸质版文件同时上传伦理批件,即伦理批件提供时间延后。
申请人和申请书填写单位在审批和备案中的要求都是相同的,即申请人为具有法人资格的中方单位、外方单位;填报单位为申办方或医疗机构(组长单位),且为中国境内依法成立的法人单位。
当满足采集条件时,在国际合作科学研究审批或临床试验备案的基础上申报采集审批(若申报临床试验备案,需先申报采集审批;若报科学研究审批,可同时申报采集审批)。
采集审批的适用范围如下:
若有人类遗传资源材料出境(实体样本),则需申报材料出境审批。如同时申报国际合作科学研究审批,可在国际合作科学研究审批申报中列明出境计划,获批后再行申报材料出境审批可走简化流程。
若涉及人类遗传资源信息对外提供或公开发表(如使用外资EDC、内资EDC服务器在国外、数据提供至国外机构或个人等),需申报人类遗传资源信息对外提供或开放使用备案。信息备案的申请人为中方单位,且在备案前先完成平台备份登记,获得备份号后再在遗传资源管理申报平台上备案,并在实施过程及时汇总更新备份信息。
人类遗传资源管理申请的七个类别中唯一一类的登记:重要遗传家系和特定地区人类遗传资源申报登记,目前没有服务指南和管理流程,因此本文未做探讨。(作者单位:恩远医药科技(北京)有限公司)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐