每周医药看点(11.19-11.25)
- 2021-11-26 10:30
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 《医疗器械临床试验数据递交要求注册审查指导原则》《体外诊断试剂临床试验数据递交要求注册审查指导原则》《以临床价值为导向的抗肿瘤药物临床研发指导原则》等文件发布;国家药监局决定对氯膦酸二钠制剂说明书进行统一修订……11月19日-25日,医药行业的这些事情值得关注。
行业政策动态
1.国家药监局发布《医疗器械临床试验数据递交要求注册审查指导原则》和《体外诊断试剂临床试验数据递交要求注册审查指导原则》2项注册审查指导原则,指导注册申请人规范递交临床试验数据及相关资料,提高审评效率。
2.国家药监局就《禁止委托生产医疗器械目录(征求意见稿)》公开征求意见,拟禁止委托生产22种高风险植入性医疗器械。征求意见截止日期为2021年12月15日。
3.国家药监局就《医疗器械不良事件监测和再评价管理办法(修正案草案)(征求意见稿)》公开征求意见。《征求意见稿》对现行《医疗器械不良事件监测和再评价管理办法》进行了局部修改,与新修订《医疗器械监督管理条例》表述保持一致。征求意见截止日期为2021年12月22日。
4.国家药监局发布公告,决定对氯膦酸二钠制剂说明书的内容进行统一修订。氯膦酸二钠胶囊(片)、氯膦酸二钠注射液的修订要求涉及【不良反应】【注意事项】和【药物相互作用】项,注射用氯膦酸二钠的修订要求涉及【不良反应】和【注意事项】项。
5.国家医保局就《基本医疗保险医用耗材支付管理暂行办法(征求意见稿)》《医保医用耗材“医保通用名”命名规范(征求意见稿)》公开征求意见,未来的医用耗材医保支付管理,将坚持自主申报、动态调整、逐步统一,将临床价值高、经济性评价优良的医用耗材纳入医保支付范围。征求意见截止日期为2021年11月26日。
6.国家卫健委办公厅发布《关于推广三明市分级诊疗和医疗联合体建设经验的通知》,总结了三明市分级诊疗和医疗联合体建设的7条经验,提出了推进分级诊疗和医联体建设的8项重点工作任务,对推动构建分级诊疗格局,加快完善分级诊疗体系具有重要指导作用。
7.国家药监局药审中心(CDE)发布《境外已上市境内未上市经口吸入制剂仿制药临床试验技术指导原则(试行)》,进一步引导经口吸入制剂仿制药产品科学合理开发。
8.CDE发布《多发性骨髓瘤药物临床试验中应用微小残留病的技术指导原则》,以更好地指导我国多发性骨髓瘤新药研发,尤其是关键性注册临床研究中,合理应用MRD检测方法。
9.CDE发布《以临床价值为导向的抗肿瘤药物临床研发指导原则》,《指导原则》从患者需求的角度出发,对抗肿瘤药物的临床研发提出建议,以期指导申请人在研发过程中,落实以临床价值为导向,以患者为核心的研发理念,为促进抗肿瘤药科学有序地开发提供参考。
10.CDE公示第五十二批化学仿制药参比制剂目录,涉及比索洛尔氨氯地平片等药品。公示期限:2021年11月18日-12月1日。
11.国家药监局器审中心发布《关于公开征求医疗器械、体外诊断试剂申请项目立卷审查要求意见的通知》,确保进入技术审评环节的注册申报资料质量,提高审评效率。征求意见截止日期为2021年12月3日。
产品研发/上市信息
1.国家药监局通过优先审评审批程序附条件批准广州顺健生物医药科技有限公司申报的1类创新药奥雷巴替尼片上市。该药品是我国自主研发并拥有自主知识产权的创新药,用于治疗任何酪氨酸激酶抑制剂耐药,并采用经充分验证的检测方法诊断为伴有T315I突变的慢性髓细胞白血病慢性期或加速期的成年患者。
2.国家药监局通过优先审评审批程序附条件批准四川思路康瑞药业有限公司申报的恩沃利单抗注射液(商品名:恩维达)上市。该药品为我国自主研发的创新PD-L1抗体药物,适用于不可切除或转移性微卫星高度不稳定(MSI-H)或错配修复基因缺陷型(dMMR)的成人晚期实体瘤患者的治疗,包括既往经过氟尿嘧啶类、奥沙利铂和伊立替康治疗后出现疾病进展的晚期结直肠癌患者以及既往治疗后出现疾病进展且无满意替代治疗方案的其他晚期实体瘤患者。
3.国家药监局批准苏州同心医疗器械有限公司生产的创新产品“植入式左心室辅助系统”的注册申请。该产品由血泵、体外控制器、可充电锂电池、适配器、电池充电器、通讯隔离模块、监控器、手术工具、淋浴包组成,与特定人工血管配套使用,为进展期难治性左心衰患者血液循环提供机械支持,用于心脏移植前或恢复心脏功能的过渡治疗。
4.国家药监局发布3期药品批准证明文件待领信息,共包括120个受理号,涉及齐鲁制药有限公司等企业。(截至11月25日)
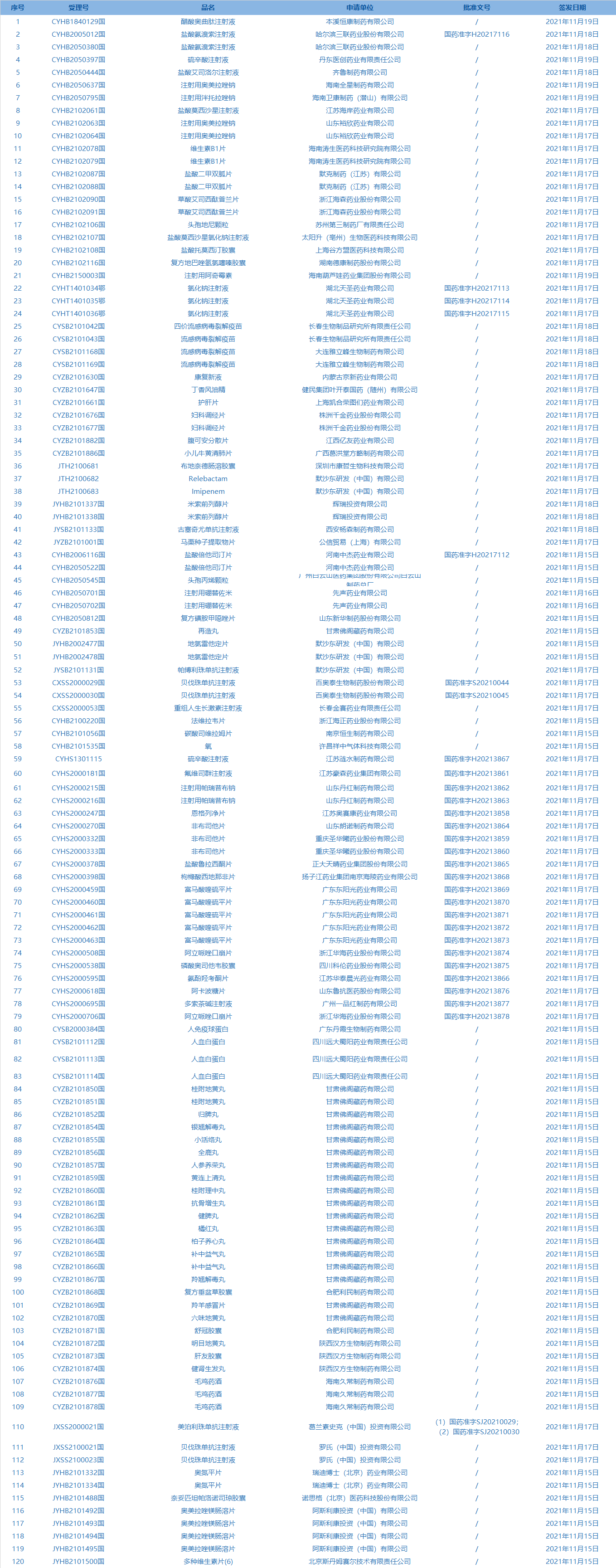
5.国家药监局发布4期医疗器械批准证明文件(准产)待领信息,共包括114个受理号,涉及山东淄博山川医用器材有限公司等企业。(截至11月25日)
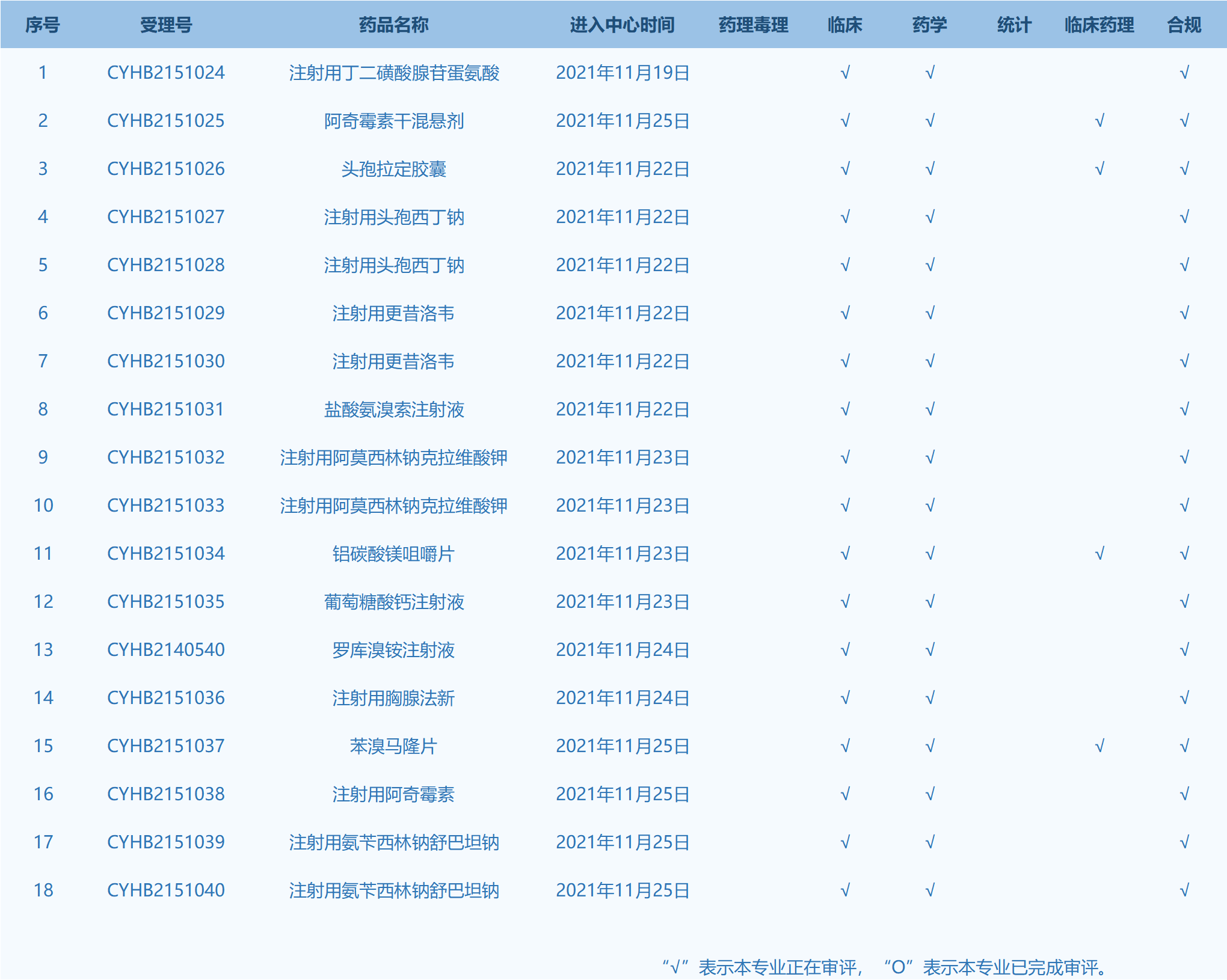
6.CDE网站公示18个仿制药一致性评价任务,涉及注射用丁二磺酸腺苷蛋氨酸等药品。(截至11月25日)
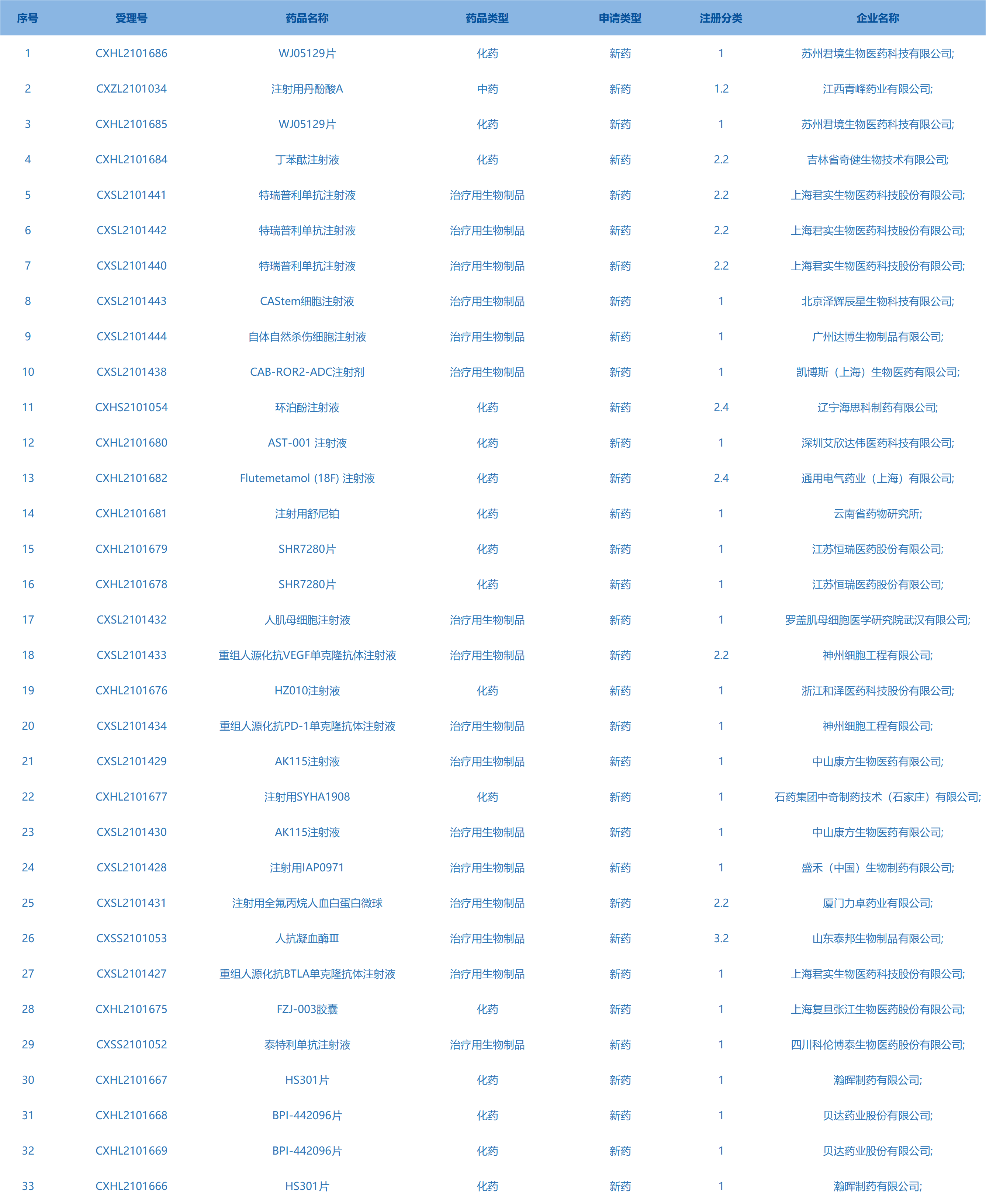
7.CDE承办受理33个新药上市申请,包括WJ05129片等药品。(截至11月25日)
医药企业观察
1.百济神州宣布,欧盟委员会(EC)批准百悦泽®(泽布替尼)用于治疗既往接受过至少一种治疗的华氏巨球蛋白血症(WM)成人患者,或作为不适合化疗免疫治疗WM患者的一线治疗方案。
2.科济药业宣布,其研发的靶向CLDN18.2的自体CAR-T候选产品CT041已获得加拿大卫生部关于临床试验申请的无异议函,该产品将在加拿大进入临床试验阶段。
3.翰宇药业发布公告称,其缩宫素原料药收到了欧洲药品质量管理局(EDQM)签发的欧洲药典适用性认证(CEP)证书。
4.普利制药发布公告称,公司收到美国FDA关于注射用盐酸万古霉素5g和10g的上市批准通知。
5.亘喜生物宣布,美国FDA授予其BCMA/CD19双靶点CAR-T产品孤儿药资格(ODD),用于治疗多发性骨髓瘤。
6.尚健生物宣布,其自主研发的全球首个靶向CD38/CD47双抗SG2501获美国FDA批准开展临床研究。
7.亚盛医药宣布,欧盟委员会(EC)授予公司1类新药奥雷巴替尼孤儿药资格,用于治疗慢性髓性细胞白血病(CML)。
8.恒瑞医药与基石药业共同宣布,双方就后者的抗CTLA-4单抗CS1002达成合作。基石药业授予恒瑞医药在大中华区研发、注册、生产和商业化CS1002的独占许可;恒瑞医药将支付基石药业总计最高约13亿元人民币的首付款和里程碑款,以及产品上市后年净销售额两位数百分比的特许权使用费。
9.药明康德子公司合全药业与同宜医药达成战略合作,携手加快同宜医药在研及后续靶向肿瘤药物的研发进程。根据合作协议,合全药业将成为同宜医药在合作研究开发生产(CDMO)领域的首选合作伙伴,为同宜医药在研及后续管线产品(包括小分子药物、多肽、寡核苷酸等)提供原料药及制剂产品的GMP工艺开发、生产、分析,以及支持新药申报的注册文件准备等一站式CMC服务,加快其创新药物的开发进度。
10.康诺亚全资附属公司康诺亚生物医药科技(成都)有限公司与石药集团全资附属公司上海津曼特生物科技有限公司,就康诺亚创新药物CM326(一种抗TSLP的重组人源化单抗)在中重度哮喘和慢性阻塞性肺病(COPD)等呼吸系统疾病独家授权开发及商业化正式签订协议。根据协议,康诺亚将授予石药CM326的独家许可,在除香港、澳门及台湾地区以外的国内其他地区进行该产品于该领域开发与商业化,并成为上市许可持有人。康诺亚将获得石药支付的人民币1亿元首付款及根据开发进度支付的最高人民币1亿元开发里程碑付款。
11.清辉联诺宣布完成1亿元人民币的Pre-A轮融资。本轮融资由中关村协同创新基金、龙磐投资、弘晖资本共同出资,资金将用于该公司异体细胞药物产品的临床试验推进、新靶点创新药物的临床前研究,以及研发中心建设等。
12.纽福斯宣布完成近4亿元人民币C轮融资。本轮融资由国投招商、红杉中国共同领投,阳光人寿、招银国际资本等共同参与投资。本轮融资所获款项将用于该公司核心产品的国际化,持续推进和丰富研发管线的项目,提升其国际化标准的生产能力。
13.艺妙神州宣布完成数亿元D轮战略融资。本轮融资由国寿大健康基金领投,广发乾和、水木深安等机构共同参与,以及该公司现有投资者国投创业、龙门基金持续支持。本次融资资金将用于加快临床推进步伐和商业化生产开发,推动该公司细胞药物IM19的开发,同时拓展面向实体瘤和UCART为代表的产品管线。
药械集中采购
1.河南省医保局发布《豫晋蒙赣粤桂渝贵滇陕青宁新兵团十四省(市、区、兵团)药品联盟采购公告(三)》,决定对阿替洛尔等38种药品开展集中带量采购。38个大品种包括26个口服常释剂型阿替洛尔、阿魏酸钠、阿昔莫司、贝尼地平、苯扎贝特等,8个注射剂维拉帕米、硝普钠、胰激肽原酶、硝普钠等,以及3个缓释控释剂型地尔硫卓、多沙唑嗪、维拉帕米,1个贴剂可乐定。
2.湖北省医保局发布《中成药省际联盟集中带量采购公告(第2号)》,要求相关药企于公告发布日至2021年11月29日在中成药资质企业申报界面维护或填报企业及产品信息、基准价格、技术评价指标等信息。
3.山东省医保局发布《关于做好国家组织药品集中带量采购协议期满后接续工作的通知》。通知明确,国家组织集采药品协议期满后,山东省以省为单位继续开展集中带量采购。坚持以人民为中心,坚持需求导向、质量优先,坚持“招采合一、量价挂钩”。约定采购量比例原则上不低于60%,采购周期原则上为3年,逐步统一各批次集采药品执行时间。
4.广东省药品交易中心发布《关于公示广东联盟阿莫西林等45个药品集团带量采购拟中选结果的通知》,涉及117个品规、133家药企。【中国食品药品网综合整理/刘思慧】
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐