每周医药看点(1月12日—18日)
- 2026-01-23 09:19
- 作者:
- 来源:中国医药报
国家药监局发布《关于化学药品和生物制品全面实施药品电子通用技术文档申报的公告》,加快推进药品电子通用技术文档(eCTD)在我国的实施进程;为配合eCTD全面实施,相关技术文件也进行了修订……1月12日—18日,医药行业的这些动态值得关注。
行业政策及药监动态
1.国家药监局发布《关于化学药品和生物制品全面实施药品电子通用技术文档申报的公告》,加快推进药品eCTD在我国的实施进程。公告明确,自2026年3月1日起,化学药品、化学原料药和生物制品的药物临床试验申请、药品上市许可注册申请、补充申请、境外生产药品再注册申请,以及仿制药质量和疗效一致性评价申请等,可按照eCTD方式申报。
2.国家医保局就“药品真实世界医保综合价值评价系列指南(试行)”公开征求意见,旨在加快建立全国统一的真实世界医保综合价值评价体系,为医保目录调整、支付标准确定、集采赋分等提供科学证据,促进医保基金更合理使用。
3.国家药监局药品审评中心(CDE)发布通告,为配合eCTD的全面实施,CDE对eCTD V3.2.2相关技术文件进行了修订。本次发布的技术文件包括《eCTD技术规范V1.1》《eCTD验证标准V1.1》等,自2026年3月1日起施行。
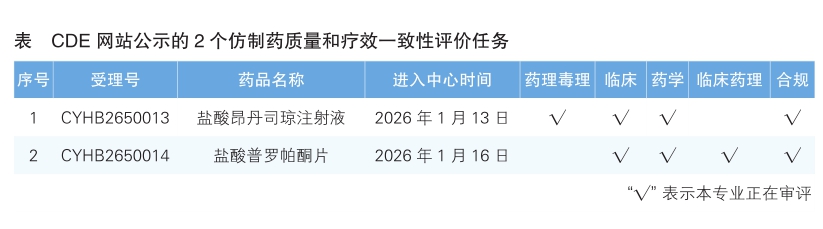
4.CDE网站公示2个仿制药质量和疗效一致性评价任务(详见表),分别为盐酸昂丹司琼注射液和盐酸普罗帕酮片。
5.国家中医药管理局综合司发布《关于征集2026年度中医药标准制修订项目建议的通知》。根据通知,此次标准制修订项目主要涉及中医药基础标准、中医药技术标准、中医药管理标准等。申报的项目建议应完成标准前期研制工作,形成相对成熟的标准草案,确保立项后18个月内(修订项目12个月)能够完成审查。
产品研发上市信息
1.国家药监局发布4期药品批准证明文件送达信息,共包括113个受理号,涉及华润双鹤药业股份有限公司等企业。
2.CDE承办受理64个新药上市申请,包括温胆汤颗粒等。
3.和誉医药宣布,其自主研发的新型口服高选择性小分子集落刺激因子1受体(CSF-1R)抑制剂盐酸匹米替尼胶囊用于腱鞘巨细胞瘤患者系统性治疗的新药申请(NDA),已获美国食品药品管理局(FDA)正式受理。
4.天泽云泰宣布,公司自主研发的用于治疗戈谢病的AAV基因治疗产品VGN-R08b获得美国FDA授予的孤儿药资格认定。
5.石药集团宣布,集团开发的强效醛固酮合成酶抑制剂SYH2072片的临床试验申请已获得美国FDA批准,适应证为未控制高血压和难治性高血压。
医药企业观察
1.荣昌生物宣布,与艾伯维就荣昌生物自主研发的新型靶向PD-1/VEGF双特异性抗体药物RC148签署独家授权许可协议。根据协议,艾伯维将获得RC148在许可区域的独家开发、生产和商业化权利;荣昌生物将获得6.5亿美元首付款,并有资格获得最高达49.5亿美元的开发、监管和商业化里程碑付款,以及在许可区域净销售额的两位数分级特许权使用费。
2.药明生物宣布,与再鼎医药针对一款创新T细胞衔接子(TCE)签署研究服务协议。根据协议条款,再鼎医药将获得该TCE在实体瘤适应证治疗上的全球独家开发与商业化权利;药明生物将获得首付款,并有资格获得开发、上市及销售里程碑付款,以及产品上市后的销售提成和再许可或其他BD交易付款。
3.复星凯瑞宣布,通过战略合作获得思比曼生物异体人源脂肪间充质干细胞注射液洛它阿托赛在许可区域的独家商业化权益。洛它阿托赛是思比曼生物基于其异体间充质干细胞技术平台开发的一款拥有自主知识产权的产品,旨在通过抑制炎症并修复受损软骨,为骨关节炎患者提供安全且长效的症状缓解,有望成为改变膝骨关节炎疾病进程的再生医学产品。
4.金赛药业宣布,与阿里健康达成战略合作。双方将在儿童健康成长、痛风防治、呼吸与过敏、女性健康、儿童神经与精神健康及营养补充六大板块开展深度协同。金赛药业将依托其在生物医药研发、临床诊疗经验等方面的核心竞争力,结合阿里健康在数据技术、平台运营及用户触达方面的资源,共同探索“医+药+服务”一体化数字健康新模式。
药品集中采购
1.四川省药械招标采购服务中心发布通知称,根据企业在四川省药械集中采购及医药价格监管平台提交的药品降价申请,拟调低部分药品的联动参考价格,涉及成都天台山制药股份有限公司的阿仑膦酸钠片等药品。
2.海南省医保局发布《关于做好广东联盟双氯芬酸等批次采购中选结果执行工作的通知》,明确自3月1日起同步落地广东联盟双氯芬酸、常见病慢性病药品接续及京津冀“3+N”联盟接续的中选结果,采购周期均为两年。 (刘鹤整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐