国科大在光化学触发线粒体双重损伤协同抗肿瘤研究中取得进展
- 2021-12-20 13:48
- 作者:
- 来源:中国科学院官网
在传统的肿瘤治疗手段中,基于单一模式的治疗方法(如化学疗法和放射疗法)往往在有限治疗窗口、毒副作用等方面存在问题;探索以时间-空间可控的方式、以对细胞的存活和增殖必不可少的关键性亚细胞目标为靶点的多维度协同损伤策略对于解决抗肿瘤应用中长期存在的问题具有重要意义。
线粒体是细胞能量代谢的主要来源,在肿瘤发生发展中起到重要作用;以肿瘤细胞中的线粒体为攻击对象是抗肿瘤治疗的新策略。光激活抗肿瘤疗法具有治疗部位精准可控、毒副作用小等优点,近年来受到关注。近日,中国科学院大学化学科学学院教授田志远课题组与中科院过程工程研究所研究员马光辉、魏炜团队和上海交通大学医学院附属同仁医院主任医师王玉刚团队合作在Nature Communications上,在线发表题为MOFs-Based Nanoagent Enables Dual Mitochondrial Damage in Synergistic Antitumor Therapy via Oxidative Stress and Calcium Overload的研究论文。该工作立足于光化学反应构建了以有机金属框架结构(Metal-organic frameworks,MOFs)为载体、以近红外光作为触发源、以肿瘤细胞内的线粒体作为进攻对象的抗肿瘤纳米制剂。静脉注射后,该纳米制剂借助叶酸组份的靶向作用选择性地富集到肿瘤部位;经近红外光照射,制剂中的上转换颗粒将长波长的近红外光转换为高能量的紫外光并将MOFs结构中的中心金属离子Fe (Ⅲ)还原成Fe (Ⅱ)、导致MOFs结构的崩解进而将Fe2+释放出来;一方面,触发光同步介导包埋在MOFs空腔中的光致产酸组份发生光化学反应、导致肿瘤内局部微环境的酸化。Fe2+的原位释放、局部微环境的酸化以及细胞内线粒体高表达的过氧化氢(H2O2)协同促进芬顿反应(Fenton reactions)产生高反应活性的羟基自由基(·OH),从而实现对线粒体的氧化性损伤(Oxidative stress);另一方面,细胞内微环境的酸化诱导钙离子内流和线粒体钙过载(Calcium overload)。上述两种机制的协同作用破坏肿瘤细胞内线粒体,进而高效杀伤肿瘤细胞并抑制肿瘤的生长。
除了通过近红外光触发得以实现以时-空可控的方式精准激活抑瘤作用而无需物理接触、并能克服紫外和可见光触发所遇到的组织穿透深度问题之外,该抗肿瘤纳米制剂还具有以下特点:(1)叶酸修饰和位点特异性组份(H2O2)使得氧化性损伤集中在肿瘤细胞内的线粒体上;(2)线粒体上高表达的H2O2、光诱导的Fe2+释放和光酸化三重促进因素协同强化氧化性损伤作用;(3)瘤内微环境的光酸化在加强氧化性损伤作用的同时诱导线粒体钙过载;(4)同步触发的双重损伤(氧化性损伤和钙过载)均以线粒体为损伤对象、协同诱导线粒体的失能及肿瘤细胞的死亡。在以多种肿瘤细胞为模型的体外实验中,该制剂显示了显著的抑瘤效果。尽管该抗肿瘤制剂尚处于动物水平的临床前研究阶段、实际临床疗效有待进一步确认,但在临床肝癌患者来源的异种肿瘤移植动物模型上其显著的疗效已得到证实。
国科大为研究工作的第一完成单位。研究工作得到国家自然科学基金、国家重点研发计划和国家科技重大专项计划的支持。
近年来,田志远课题组立足于新型光学活性功能材料的设计构建,在肿瘤标志物探测、肿瘤诊疗一体化、多模态协同抑瘤等方面与合作伙伴开展了一系列多学科交叉研究,在通过近红外荧光信号的动态变化程序化监控抗肿瘤药物递送、释放和响应的复合纳米平台的设计构建(ACS Applied Materials & Interfaces, 2017, 9, 27396, IF = 9.229);肿瘤细胞膜包覆仿生、近红外光激发和近红外荧光信号发射的荧光标签的设计构建,基于其组织穿透能力实现活体肿瘤的高分辨荧光成像(ACS Nano, 2018, 12, 1350, IF = 15.881);可见光同步触发抗肿瘤药物释放及原位光动力学治疗的抑瘤制剂的设计构建(ACS Applied Bio Materials, 2019, 2, 3068);基于高效的光热转换作用及血小板热敏性功能、实现近红外光触发光热治疗与免疫治疗协同抑瘤的复合仿生抑瘤制剂的设计构建(Science Advances, 2021, 7 : eabd7614, IF = 14.136)等方面取得了系列研究成果。
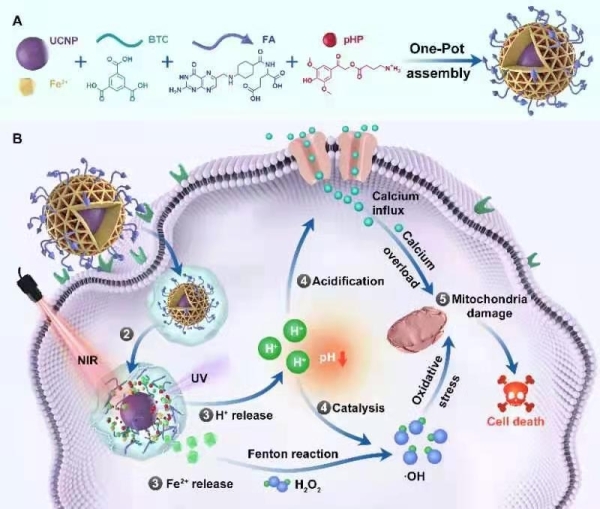
(A)抗肿瘤纳米制剂的构建:核-壳类FMUP纳米制剂以上转换纳米颗粒(UCNP)为核、以均苯三甲酸(BTC)的羧酸组份和叶酸(FA)通过与金属离子Fe3+配位形成的MOFs结构为壳,通过一锅法组装而成,光酸组份(pHP)被包埋在MOFs微腔中。(B)FMUP的抑瘤机制:①叶酸功能化促进肿瘤细胞对FMUP的主动内在化过程;②近红外光辐照导致FMUP释放出Fe2+和H+、溶酶体内的渗透压增加、发生溶酶体逃逸;③溶酶体内的Fe2+和 H+被释放到细胞质中;④细胞内微环境的光酸化诱导钙内流和线粒体钙过载、同时为芬顿反应提供其所需的酸性环境,Fe2+的释放和光酸化协同强化芬顿反应、进而在比邻线粒体处产生大量的羟基自由基;⑤钙过载和大量羟基自由基对线粒体造成双重损伤、进而导致细胞死亡
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐