9月份中美欧批准上市新药盘点:6款全球新药物获批上市
- 2022-11-04 09:32
- 作者:陈倩
- 来源:中国医药报
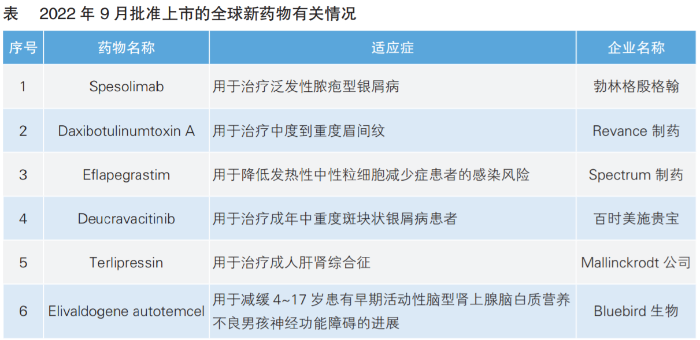
9月份,中美欧共批准14款新药上市。其中,美国批准8款新药上市,6款为全球新药物(详见表);欧盟批准6款;我国暂无新药获批。
美国批准8款新药上市
根据Pharmadigger数据库,9月份美国批准8款新药上市。其中,Spesolimab、Daxibotulinumtoxin A、Eflapegrastim、Deucravacitinib、Terlipressin和Elivaldogene autotemcel为全球首次批准。
Spesolimab-sbzo(商品名:Spevigo)由勃林格殷格翰研发,是目前全球首个也是唯一获批专门用于治疗泛发性脓疱型银屑病(GPP) 的药物。与斑块状银屑病不同,GPP是一种罕见的且可能危及生命的中性粒细胞性皮肤病,其特征是广泛暴发的疼痛性无菌性脓疱。由于该疾病非常罕见,疾病症状的识别可能具有挑战性,因此或会导致确诊延误。Spesolimab可阻断白细胞介素-36受体(IL-36R)的激活,IL-36R被证明与GPP的发病有关。此次Spesolimab获批基于一项关键性EFFISAYIL-1 Ⅱ期临床试验。试验结果显示,接受 Spesolimab 治疗的患者可见的脓疱明显少于用安慰剂的患者。此前,该药在美国已经获得孤儿药认定和优先审评资格。
Daxibotulinumtoxin A(商品名:Daxxify)由Revance制药开发,是全球首款也是目前唯一一款长效肽制剂神经调节剂,用于治疗中重度眉间纹。患者每年只需要注射两次。该药此次获批是基于一项名为SAKURA的Ⅲ期临床试验。试验结果显示,接受Daxibotulinumtoxin A注射后,98%的受试者眉间纹严重程度得到改善;中位持续时间长达6个月,一些患者甚至在9个月时仍然维持改善效果。2018年12月,复星医药就Daxibotulinumtoxin A与Revance达成合作,获得在中国市场商业化Daxibotulinumtoxin A的权利。目前,复星医药正在开展两项关于该药物用于治疗孤立性颈部肌张力障碍和中重度眉间纹的Ⅲ期临床试验。
Eflapegrastim(商品名:Rolvedon)是Spectrum制药开发的首款获美国食品药品管理局(FDA)批准的新型长效粒细胞集落刺激因子(G-CSF),通过结合在粒细胞祖细胞上表达的G-CSF受体来刺激其增殖过程,使其最终在骨髓中产生功能性活化的嗜中性粒细胞。大多数化疗引起的中性粒细胞减少症会导致患者可能出现化疗给药延迟、化疗剂量减低或化疗提前终止。Eflapegrastim此次获批是基于两项名为ADVANCE和RECOVER的Ⅲ期临床试验,与活性对照药物相比,Eflapegrastim具有相似的安全性,并在缩短化疗诱导的重度中性粒细胞减少症持续时间方面具有非劣效性。
Deucravacitinib(商品名:Sotyktu)是百时美施贵宝开发的全球首个且目前唯一获批的口服选择性酪氨酸激酶2(TYK2)变构抑制剂,用于治疗成年中重度斑块状银屑病患者。银屑病是一种常见的慢性、系统性免疫介导疾病。高达90%的银屑病患者患有斑块状银屑病,其特征是界限清楚的圆形或椭圆形斑块,表面通常覆有银白色鳞屑。该药此次获批是基于POETYK PSO-1和POETYK PSO-2两项关键Ⅲ期临床试验的研究结果。对于中重度斑块状银屑病患者,Deucravacitinib的疗效优于安慰剂及Apremilast。
Terlipressin(商品名:Terlivaz)是全球首个获FDA批准用于改善成人肝肾综合征(HRS)患者肾功能的疗法,由Mallinckrodt公司开发。HRS是一种急性且危及生命的疾病,常见于晚期肝病患者。HRS分为快速进展型和慢性进展型,前者会导致患者急性肾功能衰竭,通常需要住院治疗,而后者会在数周至数月内进展。Terlipressin为内源性加压素的合成类似物,具有收缩血管和抗出血的药理作用,可降低肝脏血流量和门静脉压。此次获批是基于名为CONFIRM的Ⅲ期临床试验结果。快速进展型HRS患者使用Terlipressin后实现HRS逆转的比例显著高于安慰剂组。
Omidenepag isopropyl(商品名:Omlonti)是参天制药开发的选择性前列腺素E2受体(EP2)激动剂,可同时增加小梁网和葡萄膜巩膜的房水外流以发挥降低眼内压的效应。该药已于2018年在日本获批上市。
Sodium phenylbutyrate/taurursodiol(苯丁酸钠和牛磺酸二醇口服固定剂量配方,商品名:Relyvrio)是Amylyx制药开发的首款在随机、安慰剂对照临床试验中能显著延缓渐冻症疾病进展并能延长患者生存期的治疗药物。该疗法可以改善细胞内线粒体和内质网的健康状态,从而延缓神经细胞的死亡。该药已于今年6月获得加拿大药品监管机构的批准有条件上市。
Elivaldogene autotemcel(商品名:Skysona)是Bluebird生物公司开发的首款用于治疗早期脑性肾上腺脑白质营养不良的基因疗法。肾上腺脑白质营养不良(ALD)是一种罕见的X染色体连锁代谢疾病,主要影响男性。该药的获批是基于名为ALD-102的Ⅱ/Ⅲ期临床试验和ALD-104的Ⅲ期临床试验。根据研究结果,经Elivaldogene autotemce治疗的患者在首次症状发作(神经功能评分NFS≥1)的24个月内估计有72%的无主要功能障碍生存率,是未经治疗患者的约1.6倍。
欧盟批准6款新药上市
Pharmadigger数据库显示,9月份欧盟共批准6款新药上市,无全球首次批准新药。
Tezepelumab(商品名:Tezspire)是阿斯利康开发的首个也是唯一一个获欧盟批准的不受表型或生物标志限制的治疗严重哮喘生物药。TSLP是一种针对促炎性刺激(例如肺内过敏原、病毒及其他病原体)产生的上皮细胞因子,在哮喘患者气道中的表达增加,并与疾病严重程度相关。Tezepelumab是TSLP单抗药物,获批基于名为PATHFINDER的临床试验结果:与安慰剂相比,Tezepelumab在降低重度、不受控制的哮喘患者的年平均哮喘急性发作率上具有统计学意义和临床意义。该药最早于2021年12月获FDA批准上市。
Vutrisiran(商品名:Amvuttra)是Alnylam制药开发的可皮下注射的RNAi疗法。此次批准基于名为HELIOS-A的Ⅲ期临床试验。结果显示,该药显著改善了hATTR淀粉样变性的体征和症状,超过50%患者的多发性神经病表现停止或逆转。Vutrisiran此前已于2022年6月获FDA批准上市。
Voclosporin(商品名:Lupkynis)是大冢制药开发的一款口服钙调神经磷酸酶抑制剂。狼疮性肾炎是系统性红斑狼疮(SLE)累及肾脏所引起的一种免疫复合物性肾炎,是SLE主要的合并症和死亡原因。Vocl ospor in是环孢菌素A的一种类似物,可与亲环素蛋白A结合形成异二聚体复合物,再结合并抑制钙调磷酸酶,阻断IL-2的表达和T细胞介导的免疫反应,稳定肾脏功能。该药最早于2021年1月获FDA批准上市。
Fosdenopterin(商品名:Nulibry)是Origin Biosciences公司开发的首款cPMP底物替代疗法。A型钼辅因子缺乏症(MoCD)是一种十分罕见的常染色体隐性遗传疾病,是由对亚硫酸氧化酶(SOX)活性至关重要的钼辅因子(MoCo)合成中断引起的。Fosdenopterin可以替代cPMP并允许MoCo的合成步骤继续进行,在激活MoCo依赖性酶的同时消除亚硫酸盐,减轻中枢神经系统症状,进而降低A型MoCD患者的死亡率。该药最早于2021年2月获FDA批准上市。
Relatlimab与Nivolumab固定剂量抗体组合疗法(商品名:Opdualag)是百时美施贵宝开发的固定剂量复方制剂。该产品最早于2022年3月获FDA批准上市。
Faricimab(商品名:Vabysmo)是罗氏开发的一款双特异性抗体,同时靶向作用于血管内皮生长因子A(VEGF-A)和血管生成素2(Ang-2)这两条不同的信号通路。Faricimab最早于2022年1月获FDA批准上市。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐