舆情看点|礼来新药能否成为阿尔茨海默病的“拐点”?
- 2023-06-06 16:19
- 作者:
- 来源:中国食品药品网

事件概述
5月4日,美国药企礼来公司(Eli Lilly and Company,以下简称礼来)发布针对阿尔茨海默病(AD)新药Donanemab的名为TRAILBLAZER-ALZ 2的最新Ⅲ期临床数据。数据显示,与安慰剂相比,Donanemab将患者临床衰退速度减缓35%,将患者日常自理能力下降速度减缓40%。接近半数患者接受Donanemab治疗后1年内疾病未出现进展。Donanemab显著减缓了早期AD患者认知和功能的下降。Donanemab达到了基于AD综合评分量表(iADRS)评估的从基线到18个月的主要终点,试验的主要终点指标iADRS是评估患者认知和日常生活能力,例如管理财务、驾驶、参与兴趣爱好活动和谈论时事。同时,研究也达到了评估认知和功能下降的所有次要终点,并显示出与主要终点结果程度相似的具有统计学显著性的临床获益。靶向淀粉样蛋白是AD新药开发的重要方向之一。Donanemab是一种靶向N3pG的单克隆抗体,用于治疗早期AD,曾获得美国FDA突破性疗法认定(BTD),与名为N3pG的淀粉样蛋白亚型特异性结合,通过靶向这一亚型,Donanemab能够特异性地与大脑中的淀粉样斑块相结合,从而促进淀粉样斑块的清除。
基于这些结果,礼来方面表示,将尽快开展全球范围内的递交工作,并预计在本季度内向FDA递交上市申请。此外,礼来将与FDA以及全球其他监管机构合作,推动药物尽快获批,该药物有望在2024年上半年获批上市。当日,礼来股价大涨逾6%,市值突破4000亿美元。截至美东时间5月8日收盘,礼来市值4108亿美元。这一市值已成为纯药企市值第一,远超制药巨头辉瑞、罗氏,刷新全球药企纪录,距离强生的4200亿美元市值已相差无几。
但是,与其他已上市的AD药物一样,Donanemab也受到了安全性和有效性的诸多质疑。
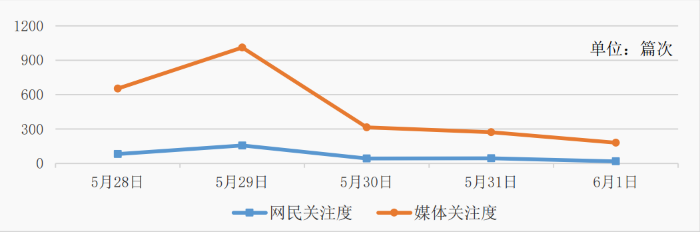
图1 关注度走势图
以5月4日至25日为监测时间段,媒体及网民关注度如图1所示,舆情走势呈“波浪式”。5月4日,礼来宣布其新药的Ⅲ期临床试验表明对AD患者明显有效,引发大量媒体转载,舆情于当日达到最高峰。5月8日,礼来股价大涨再次引发关注。
安全性有效性仍存争议
在舆论纷纷对Donanemab“具有拐点意义”“最有力的”35%的有效性欢欣鼓舞的同时,业内媒体从临床试验设计、结果数据、与其他已上市AD药物对比等方面对其有效性和安全性进行专业的解读。
近年来,FDA只批准了两款AD新药。2021年6月7日,FDA宣布加速审批卫材(Eisai)和渤健(Biogen)合作开发的单抗药物Aducanumab(商品名Aduhelm)上市,用于治疗AD源性轻度认知障碍(MCI)及轻度AD。这是自2003年以来,FDA批准的首个AD治疗新药。2023年1月6日,FDA批准了卫材和渤健合作开发的另一款AD药物Lecanemab(商品名Leqembi),用于缓解轻度和早期AD患者的认知能力下降。这两款药物同样也备受有效性和安全性质疑。在有效性方面,Aducanumab被认为虽然能够清除大脑中的β-淀粉样蛋白,但是没有足够证据表明其能够减缓或阻止AD疾病的进展。Lecanemab也仅是使AD患者的认知能力下降速度减慢27%。在安全性方面,脑出血、脑肿胀等副作用令人担忧。
礼来的Donanemab也同样受到了质疑。
一是关注Donanemab的临床试验出现的死亡等严重不良反应,质疑其安全性。如微信公众号“生物世界”发表《礼来阿尔茨海默病药物减缓认知能力下降效果创新高,市值突破4000亿美元,成为纯药企第一》称,据礼来发布的消息,在这项Ⅲ期临床试验中,有3名患者出现了ARIA(淀粉样蛋白相关成像异常)相关死亡。24%的患者出现了ARIA-E(水肿),安慰剂组为6.1%;31.4%的患者出现了ARIA-H(出血),安慰剂组为13.6%。礼来表示,大多数ARIA病例是轻度至中度的,并通过适当的管理得到解决或稳定。严重ARIA的发生率为1.6%,礼来相关方负责人表示,正如很多治疗使人衰弱和致命疾病的有效疗法一样,该疗法也可能存在严重且危及生命的相关风险。
微信公众号“氨基观察”发表《时代呼唤更好的阿尔兹海默病药物》称,作为一种慢性病,AD药物的竞争维度不局限于治疗效果,安全性问题也会得到无限放大。在治疗效果呈现更优秀的同时,Donanemab在安全性方面呈现一定劣势。总的来说,治疗组ARIA-E和ARIA-H出现的概率并不低。3名死亡患者对应868名实验组患者规模,死亡率在0.34%左右。对于AD药物来说,这一数字或许值得关注。毕竟,AD群体规模极大。这意味着因为治疗带来的死亡人数规模不会太小。不容置疑的一点是,安全性问题也将会是AD药物研发的关键。
二是认为Donanemab的临床试验数据及设计还存疑。如微信公众号“中国新闻周刊”发布《认知功能下降减慢35%,老年痴呆症治疗“拐点”到了?》称,美国阿尔茨海默病协会首席科学官玛丽亚·卡里略在一份声明中表示,这是迄今为止针对AD治疗的最有力的Ⅲ期数据,进一步强调了我们在AD领域所处的拐点。从数据看,礼来Donanemab比Lecanemab效果更亮眼。但国内外多名专家表示,基于目前双方披露的临床数据,还不足以判断哪款药物更有效。复旦大学附属华山医院神经内科主任医师郁金泰表示,对于两款药物的疗效,需要通过“头对头”临床试验才能下定论。
微信公众号“一个生物狗的科普小园”发表《重磅新药的巅峰对决:渤健/卫材与礼来的阿尔茨海默病之战即将到来》称,从受试者来说,礼来的Donanemab在招募受试者时检测了患者脑部的Tau蛋白沉积。Tau的积累也被认为和AD的病程有关。礼来主要想做的是探究Tau积累只有中度的患者中Donanemab有效性,最后试验里三分之二的受试者属于此类。35%认知障碍延缓的有效性,是在这部分中度Tau积累的受试者里取得的,如果加上剩下三分之一Tau积累更多的患者,有效性数字下降到了22%。礼来采用的是自己制定的认知障碍评估方法iADRS。该评估标准不那么常用,Lecanemab的试验根本没算iADRS,所以一些文章拿Donanemab的iADRS结果去比非常荒唐。
重金聚焦AD药物 艰难前行
据动脉新医药统计,礼来是在AD领域投入最多的企业之一,礼来的2021年主要研发支出与两项研究项目有关,Donanemab就是其中之一。虽然近期公布的实验数据令人振奋,但就在今年1月,FDA拒绝加速批准Donanemab,原因是该公司没有提交足够的接受了至少一年治疗的病人的试验数据。当时也有猜测认为,Donanemab将达不到审批要求。
2021年1月,礼来公司宣布了一项关于Donanemab的小型研究令人鼓舞的结果。这项为期两年的Ⅱ期临床试验纳入了272名轻度至中度AD症状的患者,礼来表示,相比接收安慰剂治疗的患者而言,每四周输注这种实验性药物的患者智力下降的速度减缓了32%;当进行Donanemab药物6~12个月的治疗后,患者机体不会再携带β淀粉样蛋白斑块(AD发病的标志)。
2022年4月8日,Donanemab注射液临床试验申请在中国获受理,同年6月29日,该临床试验申请获得了国家药品监督管理局的批准。截至目前,该试验结果仍未公布。
2022年11月,礼来发布名为TRAILBLAZER-ALZ4的Ⅲ期临床最新数据,该研究选择与渤健和卫材已经获批的Aducanumab“头对头”对比。经过6个月的治疗,Donanemab治疗组37.9%的患者实现脑部淀粉样蛋白的清除,而Aducanumab治疗组这一比例为1.6%。Donanemab将脑部淀粉样蛋白斑块水平减少了65.2%,Aducanumab治疗组这一比例为17.0%。
礼来AD药物研发也有过惨痛的失败经历。微信公众号“深蓝观”发表的《当阿尔茨海默成就4000亿礼来》称,早在2002年,礼来开始研发一种靶向β淀粉样蛋白的单克隆抗体——Solanezumab。公司将Solanezumab临床项目命名为EXPEDITION——“远征”。然而,在接下来的临床试验中,受试患者的认知情况并未得到良好改善。当时Solanezumab研发大约已经花了90亿美元,试验却一直进展不顺。直到2023年3月,礼来正式宣布停止Solanezumab的开发,原因是该抗体未能减缓疾病进展,算是为长达十几年的“远征”画上句点。但这趟旅途为礼来划去了AD药物研发的一个错误方向,Solanezumab只能与淀粉样蛋白β的可溶性单体形式结合,并且不能去除已经沉积在大脑中的斑块。
实际上,AD药物研发失败者众多,被业内称为“研发黑洞”“死亡之谷”,不少大型药企都在这一领域纷纷折戟。微信公众号“甲12号健闻”发表《新药临床成功,礼来破局阿尔茨海默病?》称,在AD治疗领域折戟的药企不在少数,除了礼来,强生、默沙东、辉瑞、罗氏等企业也没能逃过。2017年,默沙东宣布终止被寄希望用于攻克AD的新药Verubecestat的临床Ⅲ期试验;2018年,辉瑞宣布结束当时正在进行中的神经学类疾病研究项目,主要集中在AD及帕金森症的潜伏期、Ⅰ期、Ⅱ期的早期临床试验中;同在2018年,强生公司也宣布由于安全原因放弃另一种BACE抑制剂的试验。知乎“佰傲谷”发表《“死亡之谷”的回音?礼来阿尔茨海默药物Donanemab二期临床成功》称,辉瑞、强生、罗氏等国外大型药企都在该药物开发上遭受过不同程度的失败。2012年,辉瑞和强生在2400人的试验中失败后,停止了对AD抗体药物Bapinezumab的研发;2014年,罗氏的Gantenerumab在大型Ⅲ期试验也以失败告终;2016年,礼来公司AD药物Solanezumab在Ⅲ期临床试验最后阶段宣告失败,业界信心备受打击;2017年2月,默克宣布停止AD新药Verubecestat的临床试验。
激活AD药物研发和市场
舆论认为Donanemab的积极成果有助于证实“Aβ假说”,对于AD药物研发具有重大意义。21世纪经济报道发表《AD药物研发的黑洞与市场争夺》称,目前药企研发主要基于AD两大病理假说——Aβ假说(β淀粉样蛋白过度生成并聚集成淀粉样斑块)和Tau蛋白假说(Tau蛋白过度磷酸化后错误折叠形成神经纤维缠结),淀粉样斑块和神经纤维缠结相互协同导致脑细胞死亡引发AD。此前,该领域基础核心论文涉嫌造假,北京大学第一医院神经内科主任孙永安指出,Aβ学说本身还是有基础的,现在受质疑更多的是Aβ*56。Aβ假说的提出距今已有30多年,但临床试验屡屡碰壁。自2000年Aβ疫苗AN1792进入临床Ⅱ期开始,20余年间Aβ靶点药物研发几乎覆没,使假说蒙上一层阴影。相关数据显示,Lecanemab是渤健和卫材在Aduhelm之后推出的第二款靶向Aβ淀粉样蛋白的AD药物,为Aβ假说提供坚定支撑。无疑,Donanemab的Ⅲ期试验结果为Aβ假说研发再度注入了强心剂。
健识局发表《药物开发史上最大黑洞爆冷!Ⅲ期临床数据让礼来市值全球登顶》称,这两年,全球医药界研发上市的AD药物主流方向就是证明Aβ假说。其中,渤健贡献了一款单抗,中国的绿谷制药贡献了一款甘露特纳(商品名“九期一”)。2019年12月29日,绿谷的甘露特纳在中国上市,原理是通过重塑肠道菌群平衡,间接降低β淀粉样蛋白沉积,从而改善认知功能障碍。核心还是基于Aβ假说。如今,礼来的数据或将打破僵局。华尔街分析师预计,礼来的Ⅲ期临床结果,加上今年1月份渤健另一款报批的药物Lecanemab发布过的数据,将有助于证实Aβ假说。事实上,一旦Aβ假说被证实,中国的绿谷制药的甘露特纳也会获得更具说服力的学术支持。这正是礼来Ⅲ期临床数据对全球研发者的重大意义。
澎湃新闻发表《第二款证明“淀粉样蛋白假说”可行性的AD新药或将上市?》称,全球健康药物研发中心(GHDDI)主任、清华大学药学院创院院长丁胜教授表示,从药物创新的角度来看,Donanemab的研发算得上是一件“大事”。首先,在过去几十年,很多大型药企都基于Aβ假说进行了药物研发,但大部分都失败了。大部分研究人员和药企都在过去的很多年间“撤”了,甚至连假说本身也受到了质疑。但还是有人愿意坚持,也又一次印证了该假说的可能性,这增强了后续AD疗法的信心,为后续研究带来了曙光。其次,之前的失败很大程度打击了大家对AD药物疗法的信心,而这次礼来的Donanemab证明了AD药物疗法是可行的,也为其他神经退行性疾病的研发点燃了希望。在如今“管线内卷”的大背景下,还有企业坚持走别人少走的路,坚持原创研发,是具有重要意义的。
在研发方面,国内外药企也在积极布局。据同写意报道,强生针对Tau蛋白在AD患者的大脑中会错误折叠和缠结进行研究。该公司与AC Immune合作,推进一种Tau疫苗ACI-35.030的开发。在2022年CTAD,AC Immune提交了Ⅰb/Ⅱa期的中期数据,表明ACI-35.030可诱导靶向Tau蛋白的抗体产生强烈、持久的诱导。此外,4月11日,Treventis宣布与武田达成许可协议,以进一步研究、开发和商业化用于AD的靶向Tau蛋白的小分子药物。 5月11日,大冢制药和灵北制药共同宣布,FDA已批准Rexulti(brexpiprazole)的新适应症上市申请,用于治疗阿尔茨海默病。据药融云统计,截至2022年5月25日,全球共有2145个阿尔茨海默病研发药物(包括active和inactive),其中IND以上研发阶段的药物占比仅为13%,包括临床Ⅰ期107个,临床Ⅱ期105个,临床Ⅲ期51个。但值得一提的是,以上研发药物中,处于研究终止状态的药物共有343个,无后续进展报道的有975个,二者占比达到61.45%。
《中国商报》刊发《积极“抢食” 礼来欲“破局”阿尔茨海默病》称,国内药企也在积极研发治疗AD的新药。根据国家药监局备案数据,共有11项AD的临床试验记录在册,其中有2项已显示停止。恒瑞医药、先声药业等国内头部创新药企业均在积极研发,从研发进度来看,先声药业与德国药企合作研发的药物有望率先取得突破。
近20年来,AD药物新药获批者寥寥。渤健与卫材联合开发的Aducanumab在上市一年后仅仅被极少数患者使用,美国医疗保险和医疗补助服务中心(CMS)也不愿意为其提供医保覆盖。渤健曾经试图为Aducanumab辩护,并采取降价至28000美元/年的措施,但到今年4月,持续恶化的局面让渤健不得不下定决心抛弃Aducanumab。4月22日,渤健宣布撤回Aducanumab在欧洲的上市申请。除了FDA批准上市的两款药物外,我国自主研发的甘露特钠于2021年11月2日有条件批准上市,用于改善轻度至中度AD患者认知功能。在这款药物上市后,仍然被要求继续进行药理机制方面的研究,继续进行长期安全性有效性研究,并完善寡糖的分析方法。如果后续数据不理想,可能意味着这款药物会被撤回。甘露特钠的临床试验数据、作用机制方面一直饱受争议。据报道,目前甘露特钠华东某团队部分销售人员工资停发,纷纷离职。多个信源交叉印证,甘露特钠的销量不如预期。
从市场格局来看,Donanemab如果获批上市将会一定程度上激活AD药物市场。新浪号“MedTrend医趋势”发表《阿尔海默病新药一石激起千层浪,看渤健、礼来的“长期韧性”》称,对于礼来而言,Donanemab获批,一方面其市值有望冲击大健康企业第一,另一方面或许在获得市场认可后,有望助力其整体营收更上一个台阶。礼来在研发上的投入并不少。近日Fiercebiotech网站发布的“2022年全球制药企业研发投入10强”显示,礼来以71.9亿美元投入排名第8位。但是其营收似乎仍缺“临门一脚”。美国《制药经理人》杂志发布的“2022年全球制药企业TOP50榜单”显示,礼来排在第13位(与第10名的GSK相差约74亿美元)。而2023年,礼来或手握 “流量密码” Tirzepatide(Mounjaro,替尔泊肽注射液)和Donanemab。凭借这些重磅产品,礼来或将跻身全球药企TOP10。
时代财经发布《每3.2秒新增一个痴呆症患者!阿尔茨海默病迎新药,礼来与渤健正面PK》称,目前Lecanemab尚未拿到全面上市的许可,且医保报销受到严格限制。该产品以分子标记物为标准获得加速审批,在美国医保中,除非在验证有效性的临床试验里使用,否则一律不报销。专家表示,短期内这两款药物的都有巨大的潜在市场,但在上市时间上,名义上Lecanemab已经赶超Donanemab,这也给礼来的反超增加了一定困难。渤健的Aduhelm、Lecanemab和礼来的Donanemab在上市之后所面临的形势仍旧紧迫。有效性如何,对哪一部分患者有意义,这仍然是潜在的争议焦点。
舆情点评
AD药物研发的难度是业界公认的,这从各大药企巨头纷纷终止的临床试验可见一斑。AD新药研发失败的原因包括药效不佳、副作用严重、无法减缓疾病进展、临床研究设计不合理、样本量不足、人群异质性大、检测指标不准确等。因此,无论是哪一款AD药物,其研发、上市总是伴随着争议声。当前,在我国也有不少AD相关的临床试验正在进行,其临床试验设计、试验入组情况、数据结果分析等也都面临科学性、严谨性的考验。
AD药物的研发难点和争议也给药品审评工作带来很大挑战。从近年来批准的AD新药来看,国内外药品监管机构也在临床需求与药物安全有效之间寻找平衡。虽然AD药物的安全性、有效性在业内无法达成共识,但是不容忽视的是大量AD患者及其家属的迫切需求。推动新药研发仍是国内外药企以及各国监管部门积极努力的方向。(舆情监测中心)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:常靖婕)
分享至
右键点击另存二维码!
-
为你推荐
-

-

互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有










