近期医药看点(9.20—10.10)
- 2023-10-12 09:35
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 《第二批罕见病目录》发布;十部门联合印发《科技伦理审查办法(试行)》……9月20日—10月10日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局、国家卫生健康委发布《关于加强依托咪酯和莫达非尼药品管理的通知》。通知要求,生产依托咪酯原料药的药品生产企业应当按照《麻醉药品和精神药品管理条例》《关于印发〈麻醉药品和精神药品生产管理办法(试行)〉的通知》有关规定,向所在地省级药品监管部门申请办理定点生产资格,并申报2023年度生产计划。自2023年10月1日起,未取得依托咪酯原料药定点生产资质和生产计划的企业不得生产依托咪酯原料药;依托咪酯原料药和含依托咪酯的药品制剂不得委托生产。药品生产企业需用依托咪酯原料药生产含依托咪酯药品制剂的,应当向所在地省级药品监管部门报送年度需求计划,并向依托咪酯原料药定点生产企业或定点批发企业购买。
2.国家卫生健康委、科技部、工信部、国家药监局、国家中医药局和中央军委后勤保障部联合发布《第二批罕见病目录》,共收录86种罕见病。截至目前,我国共有207种罕见病被纳入目录。《第二批罕见病目录》共纳入血管性血友病Ⅲ型、神经元蜡样脂褐质沉积症、新生儿持续肺动脉高压等86种罕见病,涉及血液科、儿科、神经内科、内分泌科等17个学科。
3.科技部、教育部、工信部等十部门联合印发《科技伦理审查办法(试行)》。《办法》划定了科技伦理审查的主要范围,明确了科技伦理审查的责任主体、科技伦理(审查)委员会的设立标准和组织运行机制,明确了科技伦理审查的基本程序,确定了伦理审查内容和审查标准。根据《办法》,高等学校、科研机构、医疗卫生机构、企业等是本单位科技伦理审查管理的责任主体;从事生命科学、医学、人工智能等科技活动的单位,研究内容涉及科技伦理敏感领域的,应设立科技伦理(审查)委员会;其他有科技伦理审查需求的单位可根据实际情况设立科技伦理(审查)委员会。《办法》自2023年12月1日起施行。
4.国家药监局药品审评中心(CDE)发布《抗体偶联药物非临床研究技术指导原则》《延缓慢性肾脏病进展的药物临床试验技术指导原则》《狼疮肾炎治疗药物临床试验技术指导原则》《多发性硬化治疗药物临床试验技术指导原则》《干眼治疗药物临床试验技术指导原则》5个技术指南。
5.CDE就《艾曲泊帕乙醇胺片生物等效性研究技术指导原则(征求意见稿)》《注射用醋酸亮丙瑞林微球生物等效性研究技术指导原则(征求意见稿)》《化学仿制药生物等效性研究摘要(征求意见稿)》《化学药品注射剂配伍稳定性药学研究技术指导原则(征求意见稿)》《人源干细胞产品非临床研究技术指导原则(征求意见稿)》《化学药品仿制药口服溶液剂药学研究技术指导原则(征求意见稿)》《低分子量肝素类仿制药药学研究与评价技术指导原则(征求意见稿)》《化学仿制药注射剂过量灌装研究技术指导原则(征求意见稿)》《化学药品仿制药混悬型鼻用喷雾剂药学研究技术指导原则(征求意见稿)》《恩扎卢胺软胶囊生物等效性研究技术指导原则(征求意见稿)》《微型片剂(化学药品)药学研究技术指导原则(征求意见稿)》《罕见疾病酶替代疗法药物非临床研究指导原则(征求意见稿)》《生长激素制剂治疗生长激素缺乏症临床试验技术指导原则(征求意见稿)》《仿制药质量和疗效一致性评价受理审查指南(征求意见稿)》《中药新药用于紧张型头痛的临床疗效评价技术指导原则(征求意见稿)》《放射性化学仿制药药学研究技术指导原则(征求意见稿)》《化学仿制药参比制剂目录(第七十四批)》(征求意见稿)公开征求意见。征求意见时限均为自发布之日起1个月。
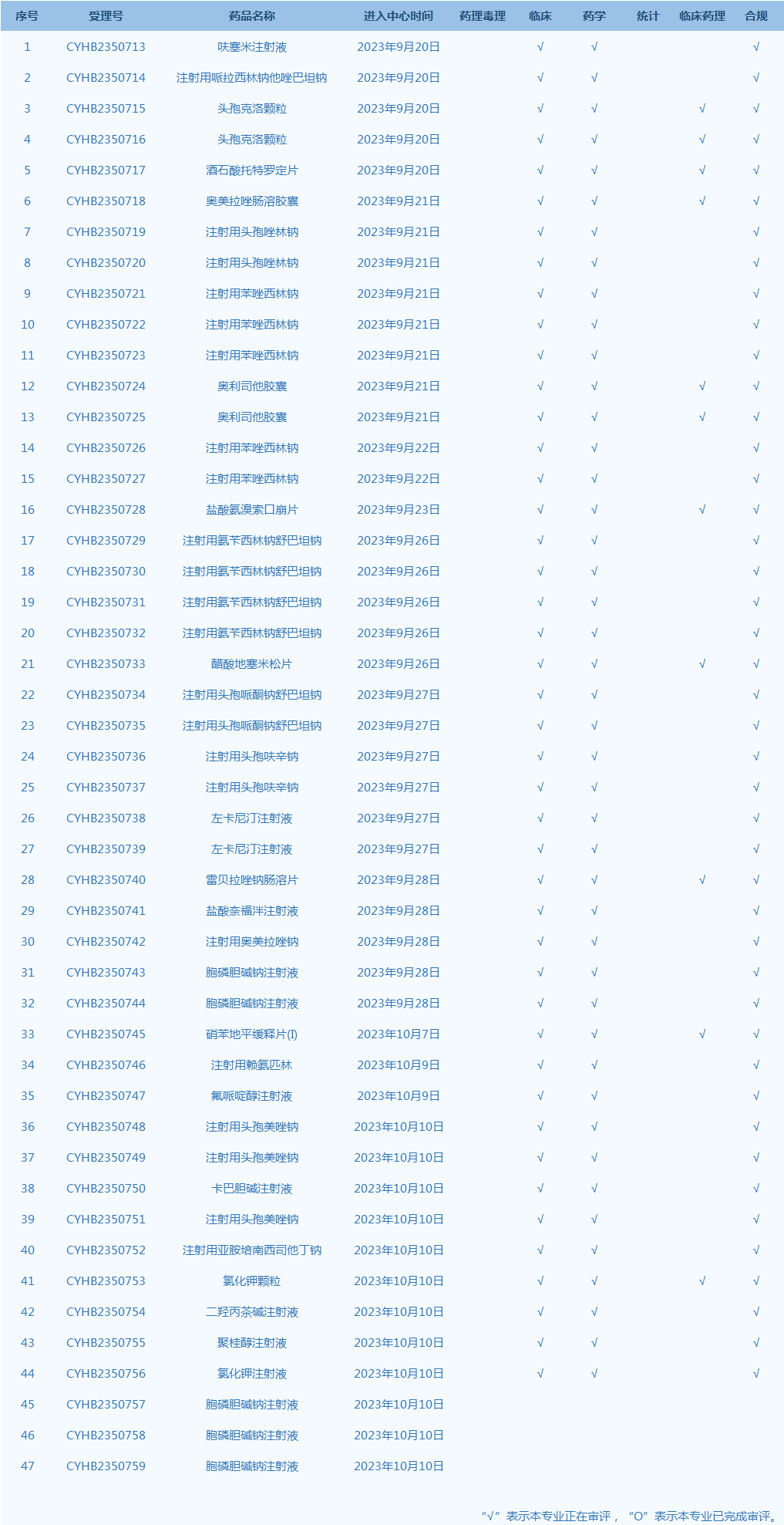
6.CDE网站公示47个仿制药一致性评价任务,涉及呋塞米注射液等品种。(截至10月10日)
产品研发上市信息
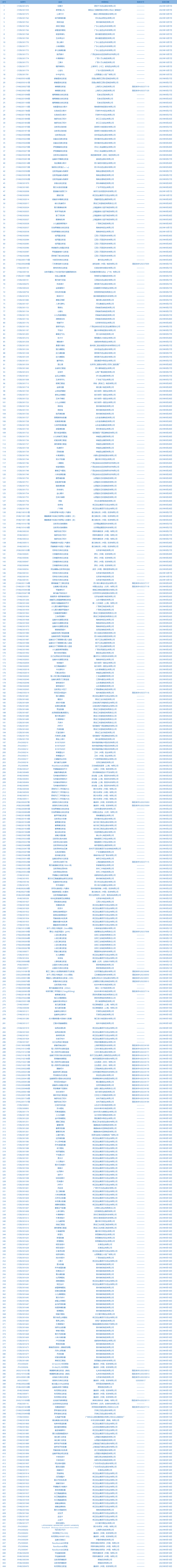
1.国家药监局发布7期药品批准证明文件送达信息,共包括444个受理号,涉及赛诺菲(中国)投资有限公司等企业。(截至10月10日)
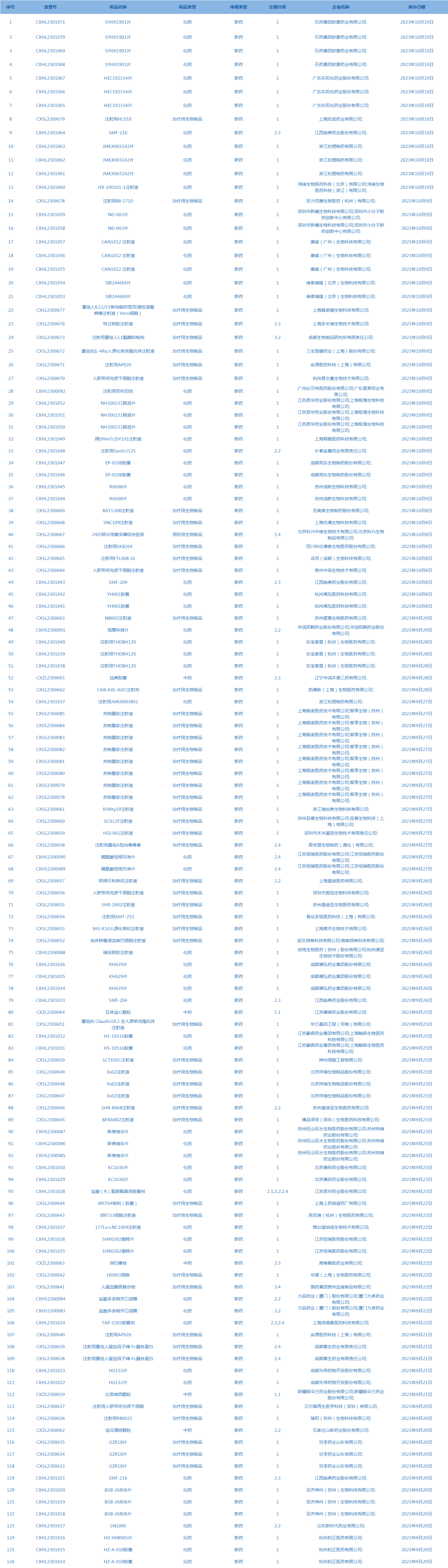
2.CDE承办受理126个新药上市申请,包括SYHX1901片等药品。(截至10月10日)
3.普利制药发布公告称,收到美国食品药品管理局(FDA)签发的碘帕醇注射液(血管内给药)上市许可;收到以色列卫生部药剂司签发的注射用阿奇霉素上市许可。
4.百奥泰发布公告称,公司合作伙伴Biogen International GmbH收到美国FDA签发的关于BAT1806注射液(托珠单抗,美国商品名:TOFIDENCE)上市批准的通知。
5.百利天恒药业发布公告称,公司自主研发的创新生物药SI-B001联合多西他赛临床试验申请获得美国FDA批准。
6.汇宇制药发布公告称,公司全资子公司Seacross Pharmaceuticals Ltd.收到巴基斯坦药品管理局核准签发的关于公司产品注射用阿扎胞苷、盐酸多柔比星注射液的上市许可;收到埃及药品管理局核准签发的关于公司产品注射用培美曲塞二钠的上市许可。
7.百济神州发布公告称,欧盟委员会已批准公司核心产品百泽安®(替雷利珠单抗注射液)作为单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)的成人患者。此外,美国FDA已受理百泽安®的一项上市许可申请,用于一线治疗不可切除的局部晚期、复发或转移性的ESCC患者。
8.人福医药发布公告称,公司控股子公司Humanwell Pharmaceutical US, Inc.(宜昌人福药业美国公司)收到美国FDA关于加巴喷丁片的暂定批准文号。
9.迈威生物宣布,美国FDA授予公司铁稳态大分子调节药物9MW3011快速通道资格,拟开发用于治疗真性红细胞增多症。
医药企业观察
1.智飞生物与GSK签署独家经销和联合推广协议。根据协议,GSK将向智飞生物独家供应重组带状疱疹疫苗,并许可智飞生物根据约定在合作区域内营销、推广、进口并经销有关产品。协议还约定GSK将优先在合作区域内任何呼吸道合胞病毒(RSV)老年人疫苗的联合开发和商业化方面成为智飞生物的独家合作伙伴。
2.恒瑞医药宣布与印度瑞迪博士实验室达成协议,将具有自主知识产权的靶向药物马来酸吡咯替尼片项目有偿许可给瑞迪博士实验室。根据协议,瑞迪博士实验室将向恒瑞医药支付300万美元的首付款、累计不超过1.525亿美元的销售里程碑款,以及达到实际年净销售额两位数比例的销售提成。
3.荣昌生物宣布,将携手康方生物旗下子公司康方药业,推进康方生物独立自主研发的PD-1/CTLA-4双特异性抗体卡度尼利单抗注射液与荣昌生物自主开发的靶向HER2的抗体偶联药物(ADC)注射用维迪西妥单抗的联合疗法的开发,并启动一项针对胃癌(含胃食管结合部腺癌)的Ⅱ期临床研究。
4.友芝友生物于9月25日在港交所正式上市。公开资料显示,友芝友生物致力于开发双特异性抗体(BsAb)疗法,用于治疗癌症相关并发症、癌症及老年性眼科疾病。根据招股书,该公司本次在港交所IPO,基石投资者有光谷健康、楚兴友瑞和朴华凯智。
5.普洛药业发布公告称,近期以自有资金200万美元在德国法兰克福投资设立全资子公司普洛欧洲有限公司,以深度实施国际化战略,进一步拓展国际市场业务,提升公司全球市场竞争力。
6.翰宇药业及全资子公司翰宇武汉与海外客户签署了日常经营重大合同。根据合同约定,客户预计向公司及翰宇武汉合计采购累计金额3000万美元的GLP-1多肽原料药。
7.力生制药发布公告称,将持有的参股公司天津医药集团财务有限公司15%股权以人民币8782.386万元的价格在天津产权交易中心公开挂牌转让。
药品集中采购
1.河南省医保局发布《关于做好全国中成药采购联盟集中带量采购中选结果落地实施相关工作的通知》,通知显示,河南将于2023年10月31日起实施全国中成药集采中选结果。河南省共参与12个中成药集采,涉及55家企业。
2.广东省医保局发布《关于落实全国中成药联盟药品带量采购和使用工作的通知》,通知明确,此次中成药集采首年采购周期从2023年10月31日至2024年10月30日,采购周期为2年,视情况可延长1年。按照采购文件要求,非中选药品需纳入监控管理,医疗机构采购非中选药品不得超过同采购组实际采购量的10%。中选企业因不能及时足量供应或质量问题等被取消中选资格时,医疗机构可选择同采购组其他企业的中选药品,优先选取日均治疗费用较低的中选药品。
3.北京市医保局发布《关于开展2023年京津冀药品带量采购有关工作的通知》,通知显示,此次集采通过招采子系统正式发布中选结果及约定任务量,中选药品价格供天津市、河北省联动共享。共有37个品种纳入集采,其中地屈孕酮口服常释剂型、艾瑞昔布口服常释剂型、多烯磷脂酰胆碱注射剂、还原型谷胱甘肽口服常释剂型等4个品种采用带量谈判外,其余33个品种均为带量联动。
(刘思慧整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐