2023年12月份美国Clinicaltrial数据库临床试验数据显示: K药相关临床试验大热 集体“围攻”非小细胞肺癌
- 2024-02-22 09:16
- 作者:陈宇哲
- 来源:中国医药报
根据美国Clinicaltrial数据库数据,2023年12月份,全球新增由企业资本主导的临床试验总数为746项,新开临床试验数量略有上升,较2023年11月份增长1.91%。单月新增临床试验数量略高于2022年同期水平,同比增长21.70%。
值得注意的是,当月与帕博利珠单抗(Keytruda,俗称K药)相关的新开临床试验数量达34项,已经超过了单克隆抗体药物的临床试验数量总和,适应证覆盖非小细胞肺癌、头颈鳞状细胞癌、黑色素瘤等,其中非小细胞肺癌适应证占据最主要份额。
新开临床试验整体情况
2023年12月份,新开临床试验数量最多的企业(机构)是默沙东,申报数量为29项;随后为阿斯利康和辉瑞,分别为26项和15项。在全球新开临床试验数量排名前十的企业中,增幅最大的是基因泰克,新开临床试验数量从上月的3项增加至当月的9项,月增幅为200%;其次为吉利德和勃林格殷格翰,增幅分别为166.67%和116.67%;增幅超过100%的企业还有默沙东,增幅为107.14%。排名前十的企业中,新开临床试验数量下滑的企业有辉瑞、艾伯维和赛诺菲,降幅分别为28.57%、33.33%和33.33%。
对比前三名企业(辉瑞、阿斯利康、默沙东)在临床适应证和药物类型方面的分布可知,三家公司竞争最为激烈的领域为呼吸道疾病,其次为乳腺癌和组织分类肿瘤领域。
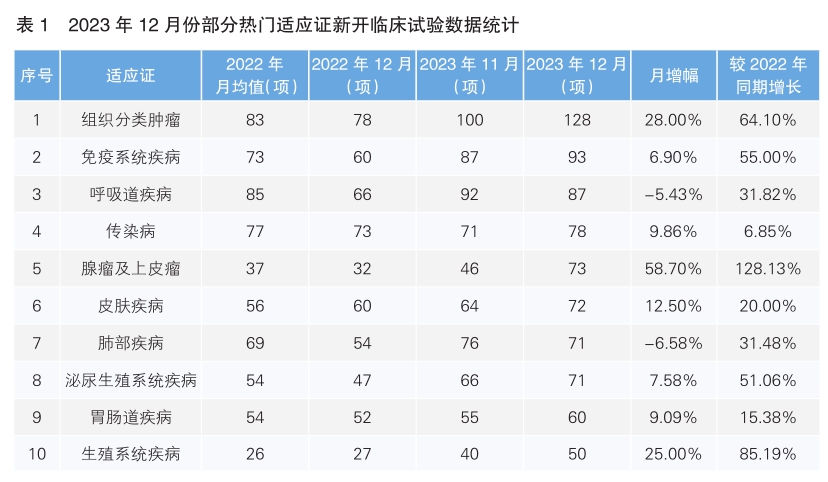
从2023年12月份新开临床试验热门适应证领域来看,组织分类肿瘤仍为最主要的热门研发领域,试验数量为128项,环比增长28%;其次为免疫系统疾病,数量相较于上月上涨6.9%。月增幅最大的热门适应证为腺瘤及上皮瘤,单月增幅为58.7%。月降幅最大的热门适应证为肺部疾病,单月降幅为6.58%。同比增幅最为明显的热门适应证是腺瘤及上皮瘤疾病,为128.13%;同比增幅最小的为传染病,增幅为6.85%(详见表1)。
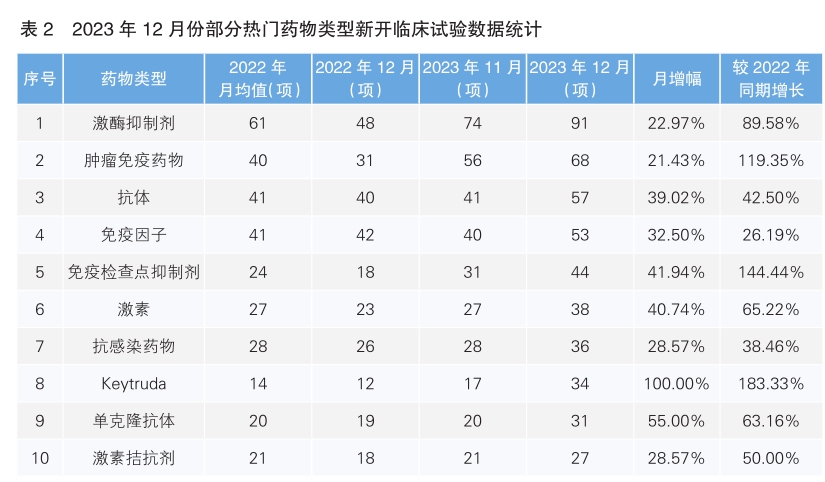
对新增临床试验药物类型进行统计后发现,2023年12月份最为热门的药物类型仍为激酶抑制剂,环比增幅为22.97%,同比增长89.58%;其次为肿瘤免疫药物,环比增长21.43%,同比增长119.35%。月增幅最大的药物类型是Keytruda,月增幅为100%,同比增长183.33%。月增幅第二的药物类型是单克隆抗体,月增幅为55%,同比增长63.16%(详见表2) 。
对新开临床试验的申请国家和地区进行统计后发现,当月美国仍为开展临床试验最多的国家,其次是中国。相较于2023年11月份,热门国家和地区新开展的临床试验数量几乎均呈现显著下降趋势,只有中国没有下降。降幅最大的为加拿大,减少了52.94%。
“摸着K药过河”成风潮
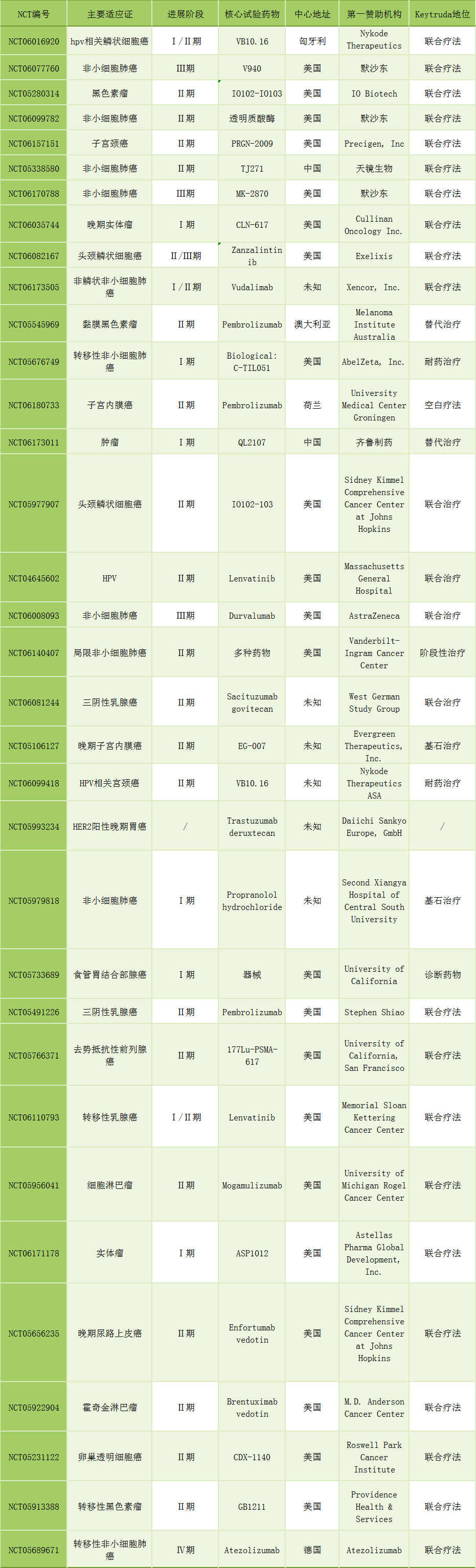
Keytruda由默沙东研发生产,属于程序性细胞死亡蛋白1(PD-1)抑制剂的一种,是目前最成功的癌症免疫治疗药物。默沙东2023年年报显示,Keytruda凭借250亿美元的销售额,成为新的全球“药王”。2023年12月份,Keytruda标签的新开临床试验数量已经超过了单克隆抗体药物的临床试验,达34项(详见表3)。
表3 Keytruda相关临床试验情况统计
在Keytruda相关临床试验中,由原研厂家默沙东作为第一申办方的临床试验仅有3项,其余均为其他厂商或研究机构作为第一申报单位发起。有28项临床试验为探究Keytruda和其他药物的联合疗法。在这些临床试验中,Ⅲ期临床试验仅有3项,其中2项由原研厂家默沙东作为第一单位发起,另一项由阿斯利康作为第一单位发起,3项Ⅲ期临床试验的适应证均为非小细胞肺癌。
由默沙东申报的两项Ⅲ期临床试验的药物分别为V940(NCT06077760)和SKB264(MK-2870,NCT06170788)。V940/mRNA-4157由莫德纳和默沙东共同研发,是一款基于新抗原和mRNA技术的个体化肿瘤疫苗。它由单个合成的mRNA组成,可以编码来自患者独特遗传癌症标记的最多34个新抗原。这些新抗原被翻译时,会触发T细胞的激活和增殖,这些T细胞会监测体内表达这些新抗原的癌细胞。
ADC新药SKB264(MK-2870)为默沙东与科伦博泰合作的首发管线,也被默沙东明确定位为肿瘤治疗领域的“滩头阵地”(Establish Beachhead)。SKB264采取了中等毒性载荷+高DAR(小分子毒素抗体比)的设计策略,利用专有的Kt hiol连接技术和可裂解Linker,将靶向TROP2的赛妥珠单抗与拓扑异构酶1(TOPO1)抑制剂KL610023(新型贝洛替康衍生物)偶联。其中,SKB264中使用的有效载荷和连接子结构都有助于提高ADC的稳定性,从而保证药物活性。Kthiol药物连接技术可以通过形成不可逆共价结合避免同类产品中马来酰亚胺与半胱氨酸可能发生的逆“Michael加成”导致的载荷脱落,从而改善ADC稳定性,减少脱靶毒性。同时,采用肿瘤专有酶裂解的Linker片段,利用酸性肿瘤微环境选择性地向肿瘤组织释放细胞毒性载荷,又避免了在靶脱瘤毒性。
由阿斯利康申报的一项Ⅲ期临床试验(NCT06008093)的试验药物为Durvalumab(度伐利尤单抗),这是一种全人源化单克隆抗体,靶向细胞程序性死亡因子配体1(PD-L1)。值得一提的是,Durvalumab是PD-1/PD-L1单抗市场上第五个产品,也是继罗氏、默克/辉瑞产品后上市的第三个靶向PD-L1的单抗。Durvalumab能直接结合PD-L1蛋白,并抑制它与T细胞表面的PD-1蛋白和CD80的结合,肿瘤细胞就无法利用PD-L1/PD-1 途径来逃避免疫系统的追杀。Durvalumab 也正是利用这一机理,起到激活免疫系统、杀伤肿瘤细胞的作用。Durvalumab于2017年5月获美国食品药品管理局(FDA)批准,用于治疗晚期或转移性尿路上皮癌;于2018年2月获FDA批准用于治疗Ⅲ期不可手术切除、接受初始放化疗的治疗后无进展的局部晚期非小细胞肺癌患者,是近20年来首款获批用于降低Ⅲ期不可切除非小细胞肺癌疾病进展风险的药物。(陈宇哲)
(数据来源于美国 Clinicaltrial 数据库,标签间存在统计重复,统计时间为2024年1月7日)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐