近期医药看点(3月25日—4月7日)
- 2024-04-09 10:56
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国家药监局印发《药品抽检探索性研究原则及程序》;《国家药品不良反应监测年度报告(2023年)》《国家药品抽检年报(2023)》发布;七叶皂苷钠搽剂、灵莲花颗粒、丹栀逍遥胶囊等由处方药转换为非处方药……3月25日—4月7日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局发布通知,印发《药品抽检探索性研究原则及程序》(以下简称《原则及程序》),进一步规范药品抽检工作,指导各地药品监管部门及药品检验机构科学开展探索性研究,更好地发挥药品抽检服务药品监管的实际效能。根据《原则及程序》,探索性研究是指在药品抽检中,除按照药品标准进行检验并判定药品是否符合标准规定之外,根据监管工作需要,进一步针对抽检样品可能存在的质量风险,采用药品标准以外的检验项目和检测方法对药品质量进行进一步分析研究的过程,可为防控潜在风险隐患、提升药品质量水平、加强药品监管提供技术支撑。《原则及程序》内容涵盖适用范围、探索性研究基本原则、探索性研究工作要点、问题发现与处置、质量分析工作要点,附有质量分析所需的统计学分析要点、综合评分方法、质量分析报告撰写指南3个附件。
2.国家药监局发布《关于调整麻醉药品和精神药品进出口准许证管理有关事宜的公告》。自公告发布之日起,申请人提交的准许证申报资料及补充资料,调整为电子形式提交,无须提交纸质申报资料。现有受理、审批和发证等工作程序不变。取得准许证的申请人,应当将申报资料涉及的进口国主管部门出具的进口准许证原件、进出口单位资质证明文件公证或认证文本原件等保存至所取得准许证有效期满后两年备查。
3.国家药监局发布公告,七叶皂苷钠搽剂、灵莲花颗粒、丹栀逍遥胶囊、秋水健脾散、胃舒宁片由处方药转换为非处方药。品种名单及其非处方药说明书范本一并发布。
4.国家药监局发布公告,决定对替硝唑注射剂(包括替硝唑氯化钠注射液、替硝唑葡萄糖注射液、注射用替硝唑)、西沙必利口服制剂(包括西沙必利片和西沙必利胶囊)、羟苯磺酸钙口服制剂(包括羟苯磺酸钙胶囊、羟苯磺酸钙片、羟苯磺酸钙分散片、羟苯磺酸钙颗粒)说明书内容进行统一修订。
5.国家药品不良反应监测中心发布《国家药品不良反应监测年度报告(2023年)》(以下简称《报告》)。《报告》显示,2023年,全国药品不良反应监测网络收到《药品不良反应/事件报告表》241.9万份,每百万人口平均报告数为1716份,全国98.5%的县级地区报告了药品不良反应/事件。
6.中国食品药品检定研究院发布《国家药品抽检年报(2023)》(以下简称《年报》)。《年报》显示,2023年国家药品抽检共完成132个品种18762批次制剂产品与中药饮片的抽检任务,样品来源涉及1114家药品生产、2528家经营企业和511家使用单位,由中检院等47个承检机构负责检验样品,检出136批次不符合规定产品。
7.国家药监局信息中心、国家药监局食品药品审核查验中心就《血液制品生产检验电子化记录技术指南(征求意见稿)》公开征求意见。征求意见稿制定了在血液制品生产过程中,与血液制品生产用人血浆的采集、供应和血液制品的生产、检验过程电子化记录相关的要求,适用于血液制品上市许可持有人和生产企业,也适用于血液制品生产和检验过程质量管理计算机化相关系统的设计原则和评审依据。
8.国家药监局药品审评中心(CDE)就《司美格鲁肽注射液生物类似药体重管理适应症临床试验设计指导原则(征求意见稿)》公开征求意见。指导原则将主要适用于司美格鲁肽注射液生物类似药,旨在为体重管理适应证临床研发中需要特殊关注的问题提出建议。
9.CDE就《化学药品3类注册申请药学自评估报告(原料药)(征求意见稿)》和《化学药品3类注册申请药学自评估报告(制剂)(征求意见稿)》公开征求意见,以更好地服务申请人,指导化学药品3类仿制药的研发和申报,提高申报资料质量,推动仿制药高质量发展。
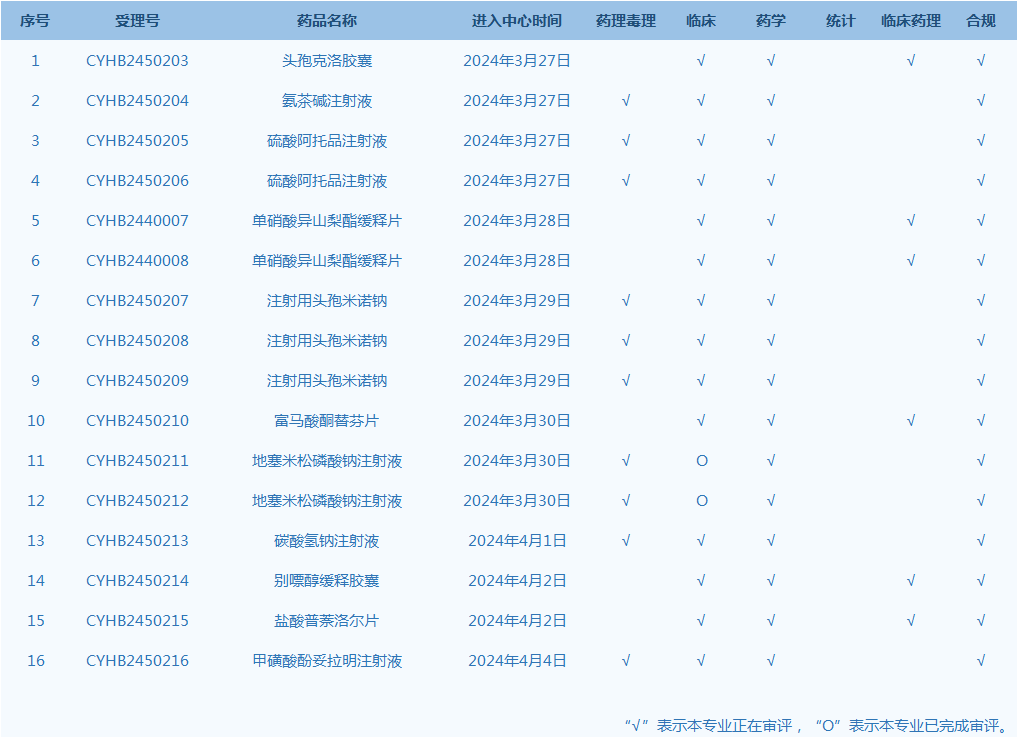
10.CDE网站公示16个仿制药一致性评价任务,涉及头孢克洛胶囊等品种(截至4月7日)。
产品研发上市信息
1.国家药监局发布7期药品批准证明文件送达信息,共包括336个受理号,涉及上海君实生物医药科技股份有限公司等企业(截至4月7日)。
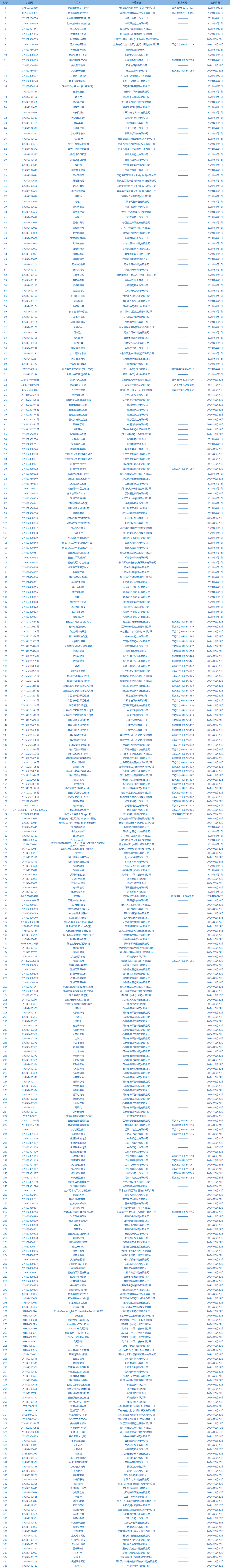
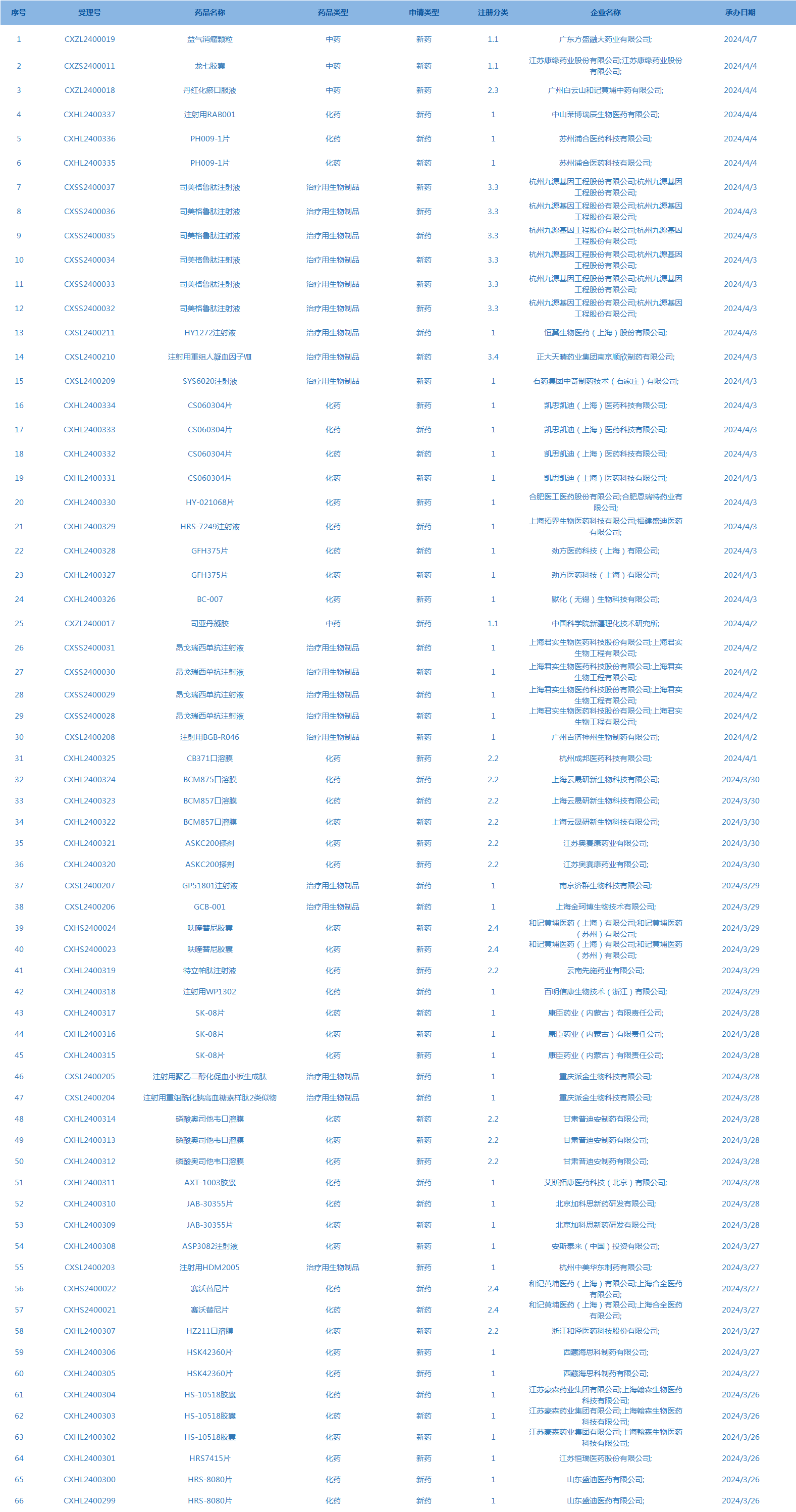
2.CDE承办受理66个新药上市申请,包括注射用RAB001等药品(截至4月7日)。
3.凡恩世宣布,美国食品药品管理局(FDA)授予其PT886快速通道资格,用于治疗转移性Claudin 18.2阳性胰腺癌患者。
4.亿帆医药宣布,其控股子公司自主研发的创新生物药Ryzneuta(通用名:艾贝格司亭α注射液)获得欧盟委员会批准在欧盟上市销售。
5.恒瑞医药宣布,其自主研发的TROP-2抗体偶联药物(ADC)注射用SHR-A1921获得美国FDA授予的快速通道资格,用于治疗铂耐药复发上皮性卵巢癌、输卵管癌及原发性腹膜癌。
6.华昊中天宣布,其核心产品优替德隆注射液获得美国FDA授予孤儿药资格,用于治疗乳腺癌脑转移。
7.礼邦医药宣布,其在研创新药物AP303获得美国FDA授予孤儿药资格,用于治疗常染色体显性多囊肾病(ADPKD)。
8.迪哲医药宣布,美国FDA授予其自主研发的新型肺癌靶向药舒沃替尼片突破性疗法认定,用于一线治疗携带表皮生长因子受体(EGFR)20号外显子插入(exon20ins)突变的晚期非小细胞肺癌(NSCLC)患者。
医药企业观察
1.中国生物制药和勃林格殷格翰共同宣布签署战略合作协议。双方将依托各自优势和资源,共同在中国大陆地区研发和商业化勃林格殷格翰的肿瘤药物管线。根据协议条款,此次战略合作涵盖多个处于临床开发阶段的创新抗肿瘤产品,包括3个处于临床开发阶段的产品口服MDM2-p53拮抗剂brigimadlin、口服选择性HER2抑制剂zongertinib和DLL3/CD3双特异性T细胞衔接器BI 764532,以及若干早期临床阶段项目。
2.康哲药业宣布,其通过全资附属公司康哲美丽与美国Incyte公司就开发和商业化选择性口服JAK1抑制剂povorcitinib订立合作和许可协议,获得该产品在许可区域内的研究、开发、注册及商业化的独家许可权利,以及在这些区域内生产产品的非独家许可权利。根据协议,康哲药业将向Incyte支付首付款,Incyte有权获得额外潜在的开发和商业化里程碑金以及基于许可产品在区域内净销售额的特许权使用费。
药品集中采购
1.国家组织药品联合采购办公室发布公告,正式开展胰岛素专项协议期满接续采购工作。采购品种范围为餐时人胰岛素、基础人胰岛素、预混人胰岛素、餐时胰岛素类似物、基础胰岛素类似物、预混胰岛素类似物,共6个采购组;采购周期自中选结果执行之日起至2027年12月31日。在中选规则上,设定了最低报价的1.3倍作为阈值,低于1.3倍中选,如果高于1.3倍,但价格不高于规定的价格线亦能中选。
2.北京市医保局发布《关于执行第九批国家组织药品集中带量采购中选结果有关工作的通知》。通知显示,北京市第九批集采中选结果,包括主供产品、备供产品以及北京市医疗保障信息平台药品和医用耗材招采管理子系统发布的视同中选药品。非主供非备供产品作为非中选药品按照有关规定调整挂网采购价格,与其他属于国家集采范围内价格适宜的非中选药品,可作为中选药品的补充进行采购销售。
3.吉林省医保局、吉林省药监局、吉林省卫生健康委、吉林省工业和信息化厅、吉林省公共资源交易中心联合发布《关于执行第九批国家组织药品集中采购吉林省中选结果的通知》。通知要求,各医疗机构应成立中选药品集中采购和使用工作小组,明确责任人和责任分工。严格执行中选药品价格,不得网下采购,要在约定采购周期内完成中选药品约定采购量,约定采购量完成后,仍应优先使用中选品种。医疗机构作为药款结算第一责任人,确保30天回款,对于不能按要求完成的医疗机构将按照相应管理办法进行处理。
4.江西省医保局发布《关于公布十六省(区)联盟药品集中带量采购中选结果的通知》,20个中选品种平均降价59.98%,按集采前价格和联盟首年约定采购量测算,预计可节约采购资金5.86亿元。(刘思慧整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐