每周医药看点(5月13日—5月19日)
- 2024-05-21 08:49
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国家药监局、国家中医药局联合发布《地区性民间习用药材管理办法》;国家卫生健康委发布推荐性卫生行业标准《全国公立医疗卫生机构药品使用监测管理标准》……5月13日—5月19日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局、国家中医药局联合发布《地区性民间习用药材管理办法》(以下简称《办法》),自2024年11月1日起执行。1987年发布的《地区性民间习用药材管理办法(试行)》同时废止。《办法》明确了地区性民间习用药材标准制定总体要求,禁止无本地区习用历史或者缺少安全性、功能主治考证或者研究等情形的品种载入省级中药材标准;提出了省级中药材标准制定修订原则,细化新增品种标准,标准的格式、用语、内容,标准收载药材的名称,以及标准备案、信息公开、标准提高等要求。《办法》确定省级中药材标准上升为国家药品标准的通路,要求省级药品监管部门根据国家药品标准收载药材品种情况及时调整其省级中药材标准收载的品种,规定了省级中药材标准废止情形。
2.国家卫生健康委发布推荐性卫生行业标准《全国公立医疗卫生机构药品使用监测管理标准》,自2024年11月1日起施行。该标准的实施应用有助于持续稳定推进药品使用监测工作、提升药品使用监测管理水平、规范药品使用监测信息化建设标准,便于监测人员熟悉掌握相关工作流程和要求。
3.国家药监局综合司就《关于发布境内生产药品再注册申报程序和申报资料要求的通告(征求意见稿)》公开征求意见,征求意见截止日期为2024年6月12日。该征求意见稿提出境内生产药品再注册申请提交、受理、审查审批、通知书送达、审查审批终止的方式、时限等具体要求,以及药品再注册批准通知书有效期计算等事宜规定。其中指出,境内生产药品上市许可持有人和化学原料药生产企业应当在药品批准证明文件(包括药品注册证书、化学原料药批准通知书、药品再注册批准通知书等)有效期届满前十二个月至六个月期间,通过国家药监局网上办事大厅在线提交药品再注册申请和生成药品再注册申请表,并提交规定格式要求的药品再注册申报资料。申请药品再注册申请时不能同时申请药品上市后变更事项。
4.国家药监局药品审评中心(CDE)发布《中药改良型新药研究技术指导原则(试行)》。指导原则基于中药研发现状及实际研发需求,针对中药增加功能主治、改变已上市中药剂型、改变已上市中药给药途径,及已上市中药生产工艺或辅料等改变引起药用物质基础或药物吸收、利用明显改变等不同改良情形下的中药改良型新药研发的药学、药理毒理及临床研究相关技术要求进行阐述,以期为中药改良型新药研发提供技术指导和参考。
5.CDE发布《乙酰半胱氨酸颗粒生物等效性研究技术指导原则》《依托咪酯中/长链脂肪乳注射液生物等效性研究技术指导原则》《依帕司他片生物等效性研究技术指导原则》《硫辛酸片生物等效性研究技术指导原则》《利丙双卡因乳膏生物等效性研究技术指导原则》《硫唑嘌呤片生物等效性研究技术指导原则》《巯嘌呤片生物等效性研究技术指导原则》《瑞戈非尼片生物等效性研究技术指导原则》《注射用醋酸奥曲肽微球生物等效性研究技术指导原则》《奥美拉唑碳酸氢钠干混悬剂生物等效性研究技术指导原则》《奥美拉唑碳酸氢钠胶囊生物等效性研究技术指导原则》《注射用醋酸亮丙瑞林微球生物等效性研究技术指导原则》《艾曲泊帕乙醇胺片生物等效性研究技术指导原则》《恩扎卢胺软胶囊生物等效性研究技术指导原则》14项技术指导原则,进一步规范仿制药生物等效性研究。
6.CDE网站公示10个仿制药一致性评价任务,涉及醋酸奥曲肽注射液等品种(截至5月19日)。
产品研发上市信息
1.国家药监局批准海思科医药集团股份有限公司申报的1类创新药苯磺酸克利加巴林胶囊(商品名称:思美宁)上市。该药品用于治疗成人糖尿病性周围神经病理性疼痛。
2.国家药监局通过优先审评审批程序批准Entasis Therapeutics, Inc.申报的1类创新药注射用舒巴坦钠/注射用度洛巴坦钠组合包装(商品名:鼎优乐/XACDURO)上市。该药品用于治疗18岁及以上患者由鲍曼-醋酸钙不动杆菌复合体敏感分离株所致医院获得性细菌性肺炎(HABP)、呼吸机相关性细菌性肺炎(VABP)。
3.国家药监局批准上海倍而达药业有限公司申报的1类创新药甲磺酸瑞齐替尼胶囊(商品名:瑞必达)上市。该药适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M 突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。
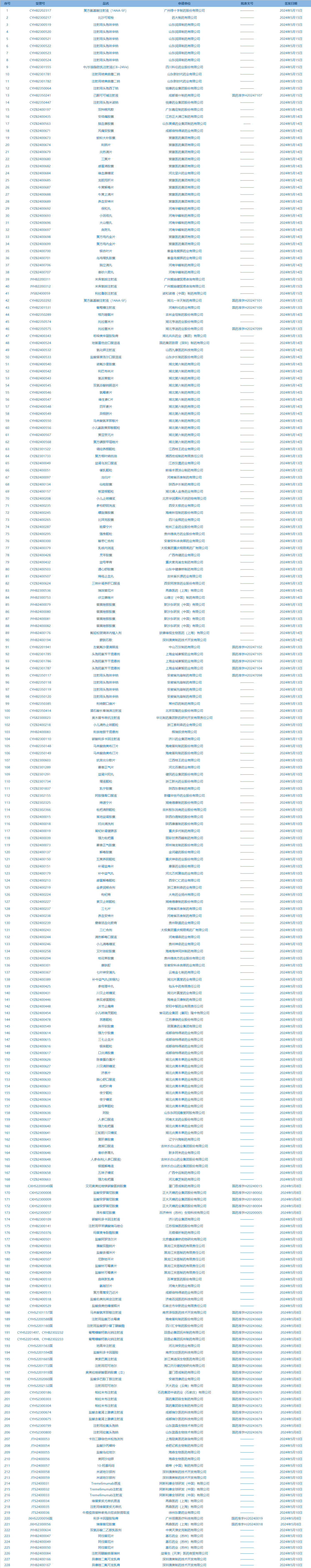
4.国家药监局发布5期药品批准证明文件送达信息,共包括228个受理号,涉及四川科伦药业股份有限公司等企业(截至5月19日)。
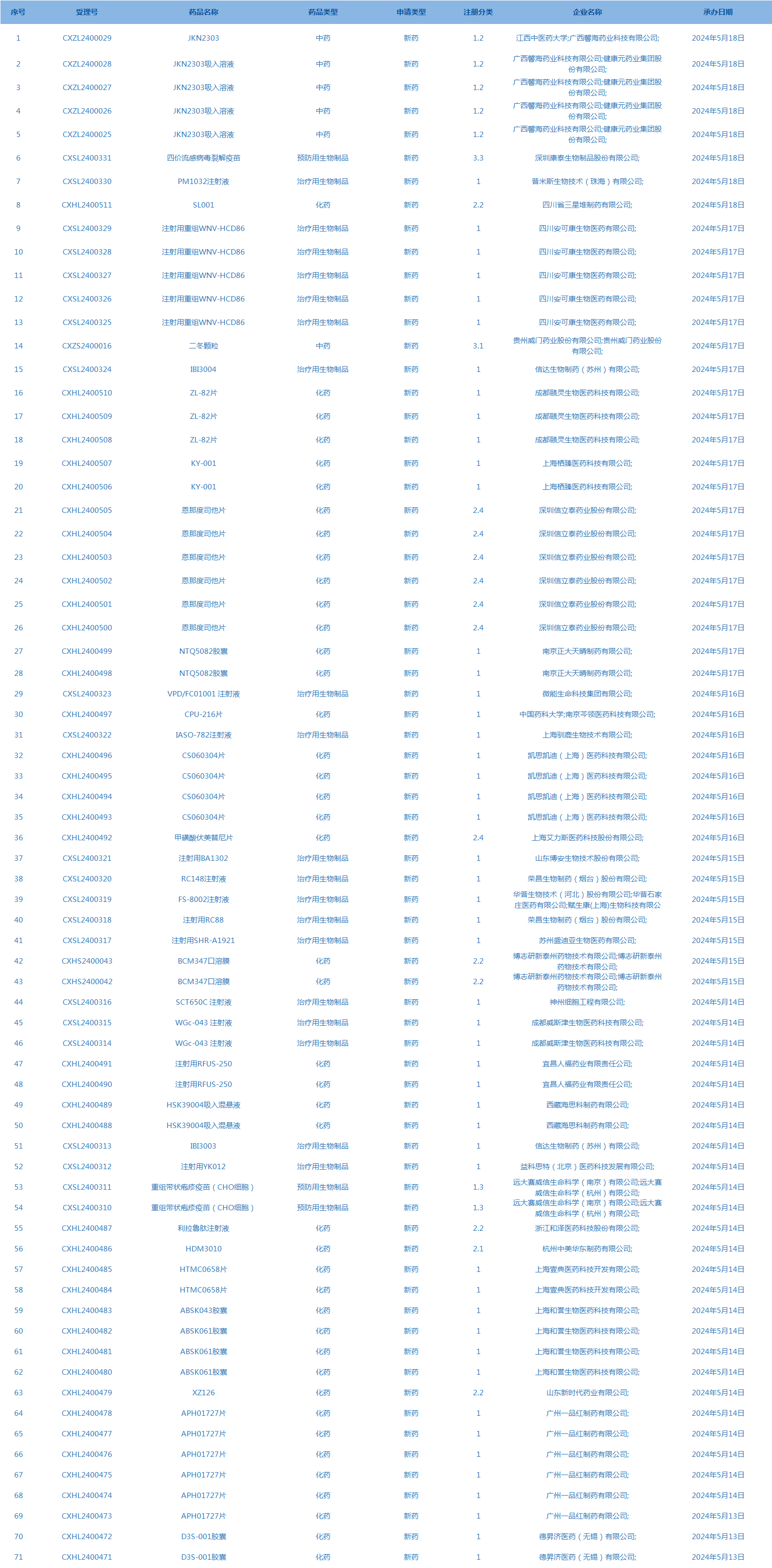
5.CDE承办受理71个新药上市申请,包括PM1032注射液等药品(截至5月19日)。
6.人福医药发布公告称,其全资子公司Epic Pharma, LLC收到美国食品药品管理局(FDA)关于乙酰唑胺片和双氟泼尼酯眼用乳液的批准文号。
医药企业观察
1.恒瑞医药发布公告称,将具有自主知识产权的GLP-1产品组合有偿许可给美国Hercules公司,Hercules公司将获得在除大中华区以外的全球范围内开发、生产和商业化GLP-1产品组合的独家权利。作为对外许可交易对价一部分,恒瑞将取得Hercules公司19.9%的股权,且将从Hercules公司获得GLP-1产品组合授权许可费。
2.嘉越医药与美国Erasca公司共同宣布签署一项全球独家授权协议。根据协议,ERASCA公司将获得Pan-RAS(ON)抑制剂JYP0015在许可区域的独家研究、开发和商业化的授权许可。嘉越医药将有资格获得首付及潜在近期付款高达2000万美元,总计最高达3.45亿美元的潜在开发、商业化里程碑及全球行使权付款等,以及净销售额的分级特许权使用费。
药品集中采购
1.安徽省医药价格和集中采购中心发布《关于进一步规范挂网药品采购限价申报工作的通知》。通知要求,以“最小零售包装”为单位申报价格。申报企业提供全国除安徽外至少3个省(自治区、直辖市)的有效挂网价格(保留小数点后两位),含最低有效省级挂网价。申报品与证明材料需严格对应,做到“五个一致”,即“医保编码”“通用名”“剂型”“规格”“生产企业”(如有上市许可持有人以“上市许可持有人”为准)均一致。同时,注射剂需严格比对“包材”,生物制剂严格比对“附加装置”。
2.上海市医药集中招标采购事务管理所发布《关于优化本市药品挂网采购机制推动高效办成一件事的通知》,进一步提升药品挂网行政服务效能。通知显示,原研药品、参比制剂、创新药品、通过国家药品监督管理部门优先审评审批程序批准上市的药品、通过(含视同通过)质量和疗效一致性评价的仿制药品、已纳入国家短缺药品清单(及国家临床必需易短缺药品重点监测清单)的药品可直接申报挂网。已有国家挂网监测价的药品,也可直接申报挂网。(刘思慧整理)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐