近期美国Clinicaltrial数据库临床试验数据显示—— 我国三家药企研发活跃度跻身全球前十
- 2026-01-29 11:02
- 作者:陈宇哲
- 来源:中国医药报
根据美国Clinicaltrial数据库数据,2025年12月份,全球新开由企业资本主导的临床试验总数为868项,数量环比上升43.47%;单月新开临床试验数量高于2024年同期水平,同比上涨28.59%。值得注意的是,我国有3家企业进入新开临床试验数量排名前十榜单,分别为圣释生物、百利天恒和金赛药业。
热门领域分布
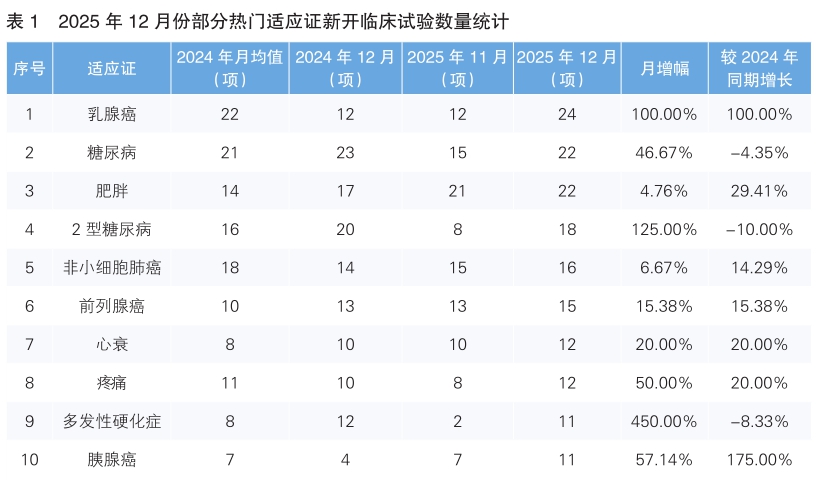
从2025年12月份新开临床试验适应证来看,乳腺癌为最热门的研发领域,新开临床试验24项,环比同比均翻一番。值得一提的是,2025年12月份针对热门适应证新开临床试验数量环比均呈上升趋势,其中多发性硬化症上升幅度最大,新开临床试验11项,环比增长450%。(详见表1)
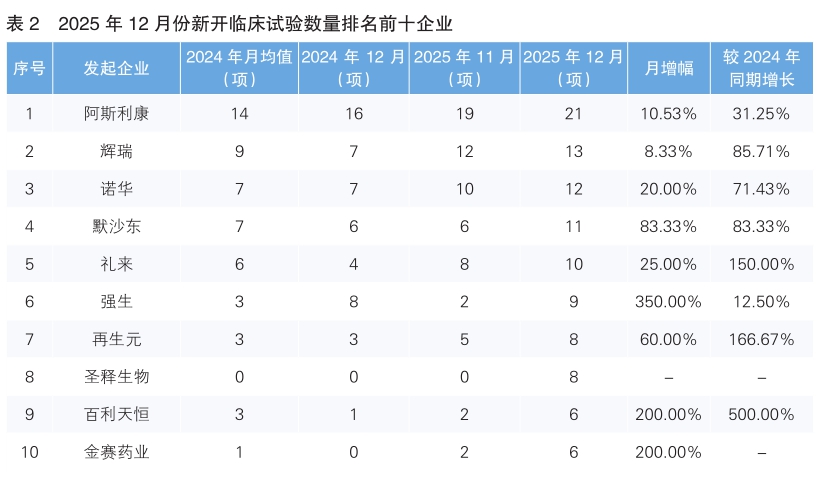
对新开临床试验的发起单位进行统计后发现,2025年12月份发起临床试验最多的企业是阿斯利康,新开临床试验21项,环比上升了10.53%,同比增长了31.25%。其次为辉瑞,新开临床试验13项,环比上升了8.33%,同比增长了85.71%。新开临床试验数量上升幅度最大的企业为强生,环比上升350%。值得注意的是,2025年12月份我国药企圣释生物、百利天恒和金赛药业进入新开临床试验数量排名前十榜单,分别新开临床试验8项、6项、6项。(详见表2)
对临床试验的申请国家和地区进行统计后发现,2025年12月份美国仍为临床试验开展最为主要的国家,新开临床试验266项;其次是中国,新开临床试验数量为151项。2025年12月份新开临床试验数量月降幅最大的是韩国,环比下降35.29%。
头部企业表现
阿斯利康2025年12月份新开的21项临床试验中,仅有1项Ⅲ期临床试验,试验药物为Rilvegostomig,适应证为胆管癌(NCT07221253)。Rilvegostomig是阿斯利康基于DuetMab分子骨架构建的一款PD-1/ TIGIT双特异性单克隆抗体,采用单价人源化IgG1抗体结构,并对Fc区域进行三重突变,以最大程度弱化Fc介导的免疫效应功能。其核心作用机制在于同时阻断PD-1和TIGIT两个免疫检查点蛋白,进而解除肿瘤微环境对T细胞的抑制效应,增强抗肿瘤免疫反应。
辉瑞2025年12月份新开的13项临床试验中,有4项为Ⅲ期临床试验,涵盖3款生物药与1款化学药。化学药的Ⅲ期临床试验药物为Abrocitinib,适应证为特应性皮炎(NCT06807281)。Abrocitinib是全球首款高选择性口服Janus激酶1(JAK1)抑制剂,能够高选择性阻断JAK1激酶活性,对JAK2/ JAK3/TYK2的抑制活性极低,有效规避了非选择性JAK抑制剂引发的广谱副作用。3项生物药Ⅲ期临床试验中有2项试验药物均为PF-08634404(原研代号:SSGJ-707),适应证分别为小肠肿瘤(NCT07222800)与晚期非小细胞肺癌(NCT07222566)。该药由辉瑞自我国药企三生制药引进,为PD-1/VEGF双特异性抗体,可同时作用于PD-1免疫检查点与VEGF血管生成因子,实现“免疫激活+抗血管生成”的双重抗肿瘤作用。另1项Ⅲ期临床试验的生物药为C.difficile疫苗,适应证为艰难梭菌相关疾病(NCT07282665)。
默沙东2025年12月份新开的11项临床试验中,仅1项推进至Ⅲ期临床,适应证为子宫颈癌(NCT07216703),试验药物为Pembrolizumab与Tirumotecan的联合疗法。该联合方案采用PD-1抑制剂+TROP2靶向抗体偶联药物(ADC)的协同治疗策略,通过免疫激活与靶向化疗双重机制杀伤肿瘤细胞;目前正处于多项Ⅲ期临床试验阶段,主要针对非小细胞肺癌、三阴性乳腺癌、子宫内膜癌等实体瘤,旨在提升一线治疗及维持治疗效果,克服单药治疗耐药性问题。
礼来2025年12月份新开的10项临床试验中,有3项为Ⅲ期临床试验,其中1项Ⅲ期临床试验的试验药物为Eloralintide,适应证为超重(NCT07282600)。Eloralintide是一款每周一次皮下注射的高选择性胰淀素受体激动剂,适用于肥胖症及2型糖尿病的治疗。其作用机制为模拟内源性胰淀素的生理功能,调节饱腹感、延缓胃排空并抑制胰高血糖素分泌,从而实现显著减重效果。该药可优先激活胰淀素受体(AMY1R、AMY2R、AMY3R),对降钙素受体的选择性较低。另外2项Ⅲ期临床试验均为肿瘤治疗研究,其中1项试验药物为LY4064809,适应证为乳腺癌(NCT07174336)。LY4064809是一款高选择性、变构型PI3Kα抑制剂,专门针对携带PIK3CA基因突变的HR+/HER2-晚期乳腺癌,通过精准靶向肿瘤细胞中的突变型 PI3Kα,在增强治疗效果的同时,减少对正常细胞的影响,降低代谢相关不良反应发生率。另1项Ⅲ期临床试验的试验药物为Vepugratinib,适应证为移行细胞癌(NCT07218380)。该药是一款口服、高效、亚型选择性小分子FGFR3抑制剂,其核心优势在于对FGFR3的高度特异性,对FGFR1/2/4的抑制活性极低,可显著降低脱靶毒性。
金赛药业2025年12月份新开的6项临床试验中,包括1项Ⅱ期临床、1项Ⅰ/Ⅱ期临床和4项Ⅰ期临床。其中,Ⅱ期与Ⅰ/Ⅱ期临床的试验药物均为GS3-007a,适应证分别为成人生长激素缺乏症(NCT07259564)和儿童生长激素缺乏症(NCT07264595)。该药是一款口服小分子生长激素促分泌剂,通过刺激垂体分泌内源性生长激素发挥治疗作用。作为金赛药业在生长激素领域的重点创新产品,GS3-007a以口服小分子促分泌剂的独特定位,为生长激素缺乏相关疾病的治疗与诊断提供了新路径。其临床开发的稳步推进,不仅有望解决现有治疗方案中患者依从性不佳的痛点,更将推动国内生长激素治疗市场的迭代升级。4项Ⅰ期临床试验中,有2项适应证为晚期实体瘤,试验药物分别为GenSci143和GenSci140。其中,GenSci143是全球首创的双特异性ADC,靶向B7-H3与PSMA双靶点,搭载TOPO-I抑制剂毒素,具有靶向化疗和肿瘤免疫双重治疗效应,主要用于转移性去势抵抗性前列腺癌及其他B7-H3/ PSMA阳性晚期实体瘤治疗。GenSci140是靶向叶酸受体α亚型(FRα)的双表位ADC,采用可裂解连接子搭载TOPO-I抑制剂毒素,可同时结合FRα的不同表位,实现对中低表达FRα肿瘤的高效杀伤。其余2项Ⅰ期临床试验中,1项试验药物为GenSci142,适应证为细菌性阴道病(NCT07302035)。GenSci142是一款重组裂解酶类创新生物制品,靶向细菌性阴道病主要致病菌加德纳菌,通过生物信息学技术从噬菌体序列中筛选并经人工智能优化获得,可直接破坏细菌细胞壁使其快速裂解死亡,兼具精准杀菌、高效清除生物膜、低耐药风险、保留阴道有益乳杆菌等核心优势。另1项试验药物为GenSci098,适应证为Graves病(NCT07286656)。该药是一款人源化抗促甲状腺激素受体(TSHR)拮抗型单克隆抗体,采用长效制剂设计,可同时作用于甲状腺和球后组织,阻断致病性自身抗体与TSHR结合,从根源抑制甲亢和甲状腺相关眼病的进展。
百利天恒2025年12月份新开的6项临床试验中,包含1项Ⅱ/Ⅲ期临床、1项Ⅱ期临床及4项Ⅰ期临床。其中,Ⅱ/Ⅲ期临床试验的试验药物为BL-M11D1,适应证为急性髓性白血病(NCT07255872)。BL-M11D1是百利天恒与时迈药业联合开发的靶向CD33的ADC药物,采用创新TOP1抑制剂Ed-04作为载荷,通过可切割连接子与CD33单抗偶联,兼具抗体依赖的细胞毒性和靶向化疗双重作用。Ⅱ期临床试验的试验药物为BL-M07D1,适应证为非鳞状非小细胞肺癌(NCT07264816)。BL-M07D1是百利天恒与时迈药业联合开发的靶向HER2的创新型ADC,以曲妥珠单抗为抗体骨架,通过组织蛋白酶B可切割连接子与新型TOP1抑制剂Ed-04偶联而成。在4项Ⅰ期临床试验中,有2项试验药物均为BL-M24D1,适应证分别为头颈部鳞状细胞癌(NCT07232524)和多发性硬化症(NCT07255898)。该药是百利天恒自主研发的创新型ADC,采用MMAE/F类微管蛋白抑制剂作为载荷,具备高稳定性与高抗肿瘤活性。其余2项Ⅰ期临床试验中,有1项试验药物为放射性药物镥[177Lu]-BL-ARC001,适应证为肺癌(NCT07274852)。该药是百利天恒基于具有自主知识产权的HIRE-ARC平台开发的全球首创抗体放射性核素偶联药物(ARC),通过高亲和力抗体靶向递送镥-177(177Lu)放射性核素发挥治疗作用。最后1项Ⅰ期临床试验的试验药物为BL-M24D1,适应证为胃肠肿瘤(NCT07279428)。该药同样采用MMAE/F类微管蛋白抑制剂作为载荷,具备高稳定性与高抗肿瘤活性。
(数据来源于美国Clinicaltrial数据库,统计时间为2026年1月10日)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐