每周医药看点(7.6~7.12)
- 2020-07-13 08:29
- 作者:李硕
- 来源:中国食品药品网
中国食品药品网讯 国务院办公厅发布关于推进医疗保障基金监管制度体系改革的指导意见,国家药监局要求进一步加强医疗器械强制性行业标准管理,疏清颗粒等17种药品转换为非处方药……7月6日~7月12日,医药行业需要关注这些大事。
行业政策动态
1.国务院办公厅发布关于推进医疗保障基金监管制度体系改革的指导意见。到2025年,基本建成医保基金监管制度体系和执法体系,形成以法治为保障,信用管理为基础,多形式检查、大数据监管为依托,党委领导、政府监管、社会监督、行业自律、个人守信相结合的全方位监管格局。
2.国家药监局发布通知,进一步加强医疗器械强制性行业标准管理有关事项。通知明确,国家药监局组织开展强制性行业标准全面评估论证,持续优化医疗器械强制性行业标准体系。需制定强制性行业标准的,尽快启动标准制定程序;需更新完善的,尽快启动修订程序;不宜强制的,转化为推荐性标准;不再适用的,及时予以废止。
3.国家药监局发布《突破性治疗药物审评工作程序(试行)》《药品附条件批准上市申请审评审批工作程序(试行)》《药品上市许可优先审评审批工作程序(试行)》,自发布之日(7月8日)起施行。原食品药品监管总局于2017年12月发布的《关于鼓励药品创新实行优先审评审批的意见》同时废止。
4.国家药监局发布2019年度中国医疗器械标准管理年报。年报显示,截至2019年底,“十三五”规划中500项医疗器械标准制修订任务已立项447项,已完成89.4%。2019年共发布国家标准5项、行业标准72项以及行业标准修改单3项,我国医疗器械标准共计1671项。
5.国家药监局发布《角膜塑形用硬性透气接触镜说明书编写指导原则(2020年修订版)》《一次性使用乳腺定位丝注册技术审查指导原则》《硬脑(脊)膜补片注册技术审查指导原则》《定制式个性化骨植入物等效性模型注册技术审查指导原则》《骨科金属植入物有限元分析资料注册技术审查指导原则》《疝修补补片临床试验指导原则》《生物可吸收冠状动脉药物洗脱支架动物实验研究指导原则》,以及YY 0485-2020《一次性使用心脏停跳液灌注器》等41项医疗器械行业标准和2项修改单。
6.国家药监局发布《关于疏清颗粒等17种药品转换为非处方药的公告》称,17种药品由处方药转换为非处方药,品种名单及非处方药说明书范本一并发布。这17种药品中包括:疏清颗粒、消疲灵颗粒、七叶神安分散片、翘栀牙痛颗粒、藿香正气胶囊、十滴水胶丸、雪梨止咳糖浆、复方益母胶囊、抗菌消炎胶囊、六味地黄咀嚼片、百令片、芩连胶囊、葛根汤片、八珍片、川贝枇杷胶囊、健脾糕片和六味补血胶囊。
7.国家药监局修订保济口服液非处方药说明书范本,要求所有保济口服液生产企业均应按照修订后的非处方药说明书范本,提出修订说明书的补充申请,于2020年10月7日前报药品监管部门备案。
8.国家药监局药审中心(CDE)发布关于上线新版药物临床试验登记与信息公示平台系统的通知,新系统将统一采用申请人之窗账户进行管理,原登记平台申请人主账户需与申请人之窗账户进行对接。此外,CDE网站“申请人之窗”栏目上线了“突破性治疗药物程序申请系统”和新版“优先审评审批申请系统”,已开通电子提交通道。附条件批准上市申请应按要求在提交药品上市许可申请时一并提交纸质申请表,不涉及电子提交通道。
9.CDE发布《药品注册申报资料格式体例与整理规范》,自2020年10月1日起施行。此外,就《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》《化学药品非处方药上市注册技术指导原则(征求意见稿)》《药品生产工艺、质量标准及说明书的通用格式和撰写指南(征求意见稿)》征求意见。
10.国家药监局器审中心开启增材制造个性化种植体注册技术审查指导原则、医疗器械中应用的纳米材料安全性有效性评价体系框架指导原则的编制工作,现征集境内外有关生产企业及其他相关单位信息。此外,就《基于同类治疗药品的肿瘤伴随诊断试剂说明书更新与技术审查指导原则(征求意见稿)》公开征求意见。
11.国家药监局食品药品审核查验中心发布药品注册申请药学研制和生产现场检查任务,涉及正大天晴药业集团股份有限公司、石药集团欧意药业有限公司等企业。
产品研发/上市
1.国家药监局发布2期药品批准证明文件待领信息,共包括8个受理号,涉及山东新时代药业有限公司等企业。
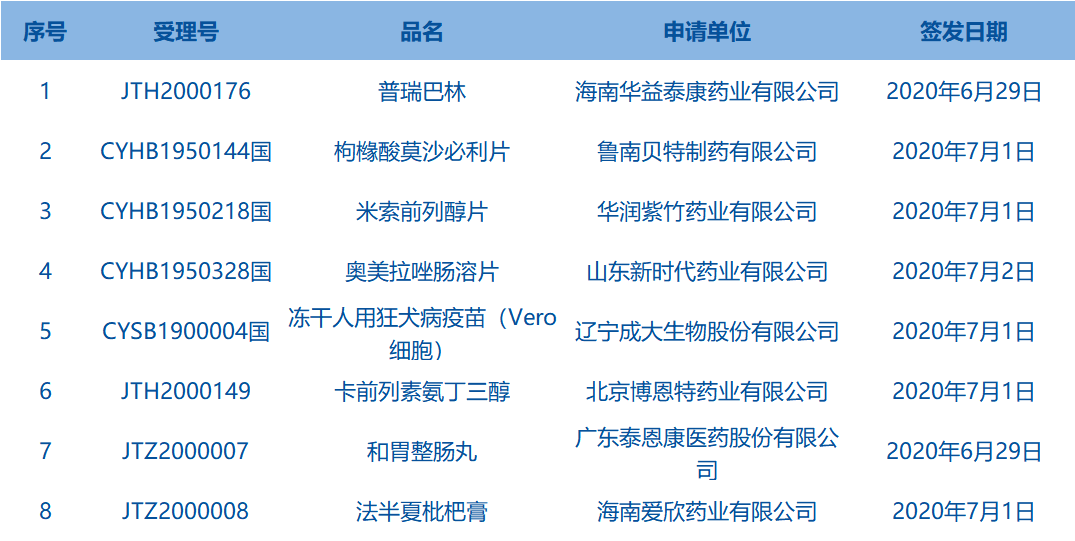
2.国家药监局发布4期医疗器械批准证明文件(准产)待领信息,共包括63个受理号,涉及天津正天医疗器械有限公司等企业。
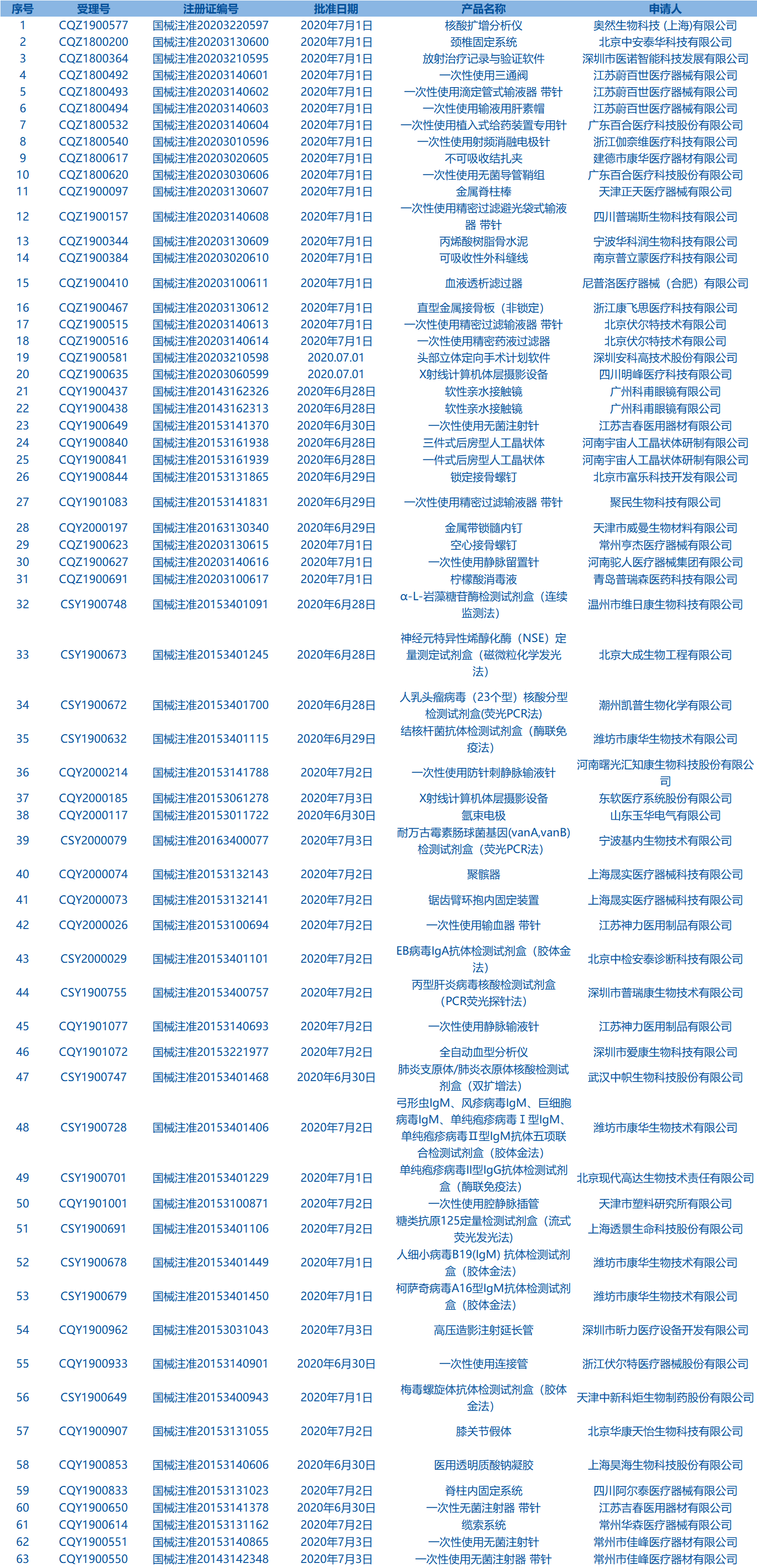
3.CDE网站公示7个仿制药一致性评价任务,涉及蒙脱石散等药品。
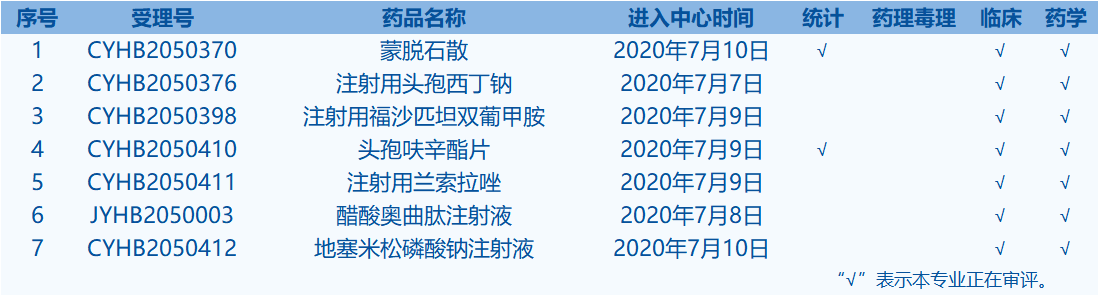
4.CDE承办受理20个新药上市申请,包括盐酸安罗替尼胶囊等药品。
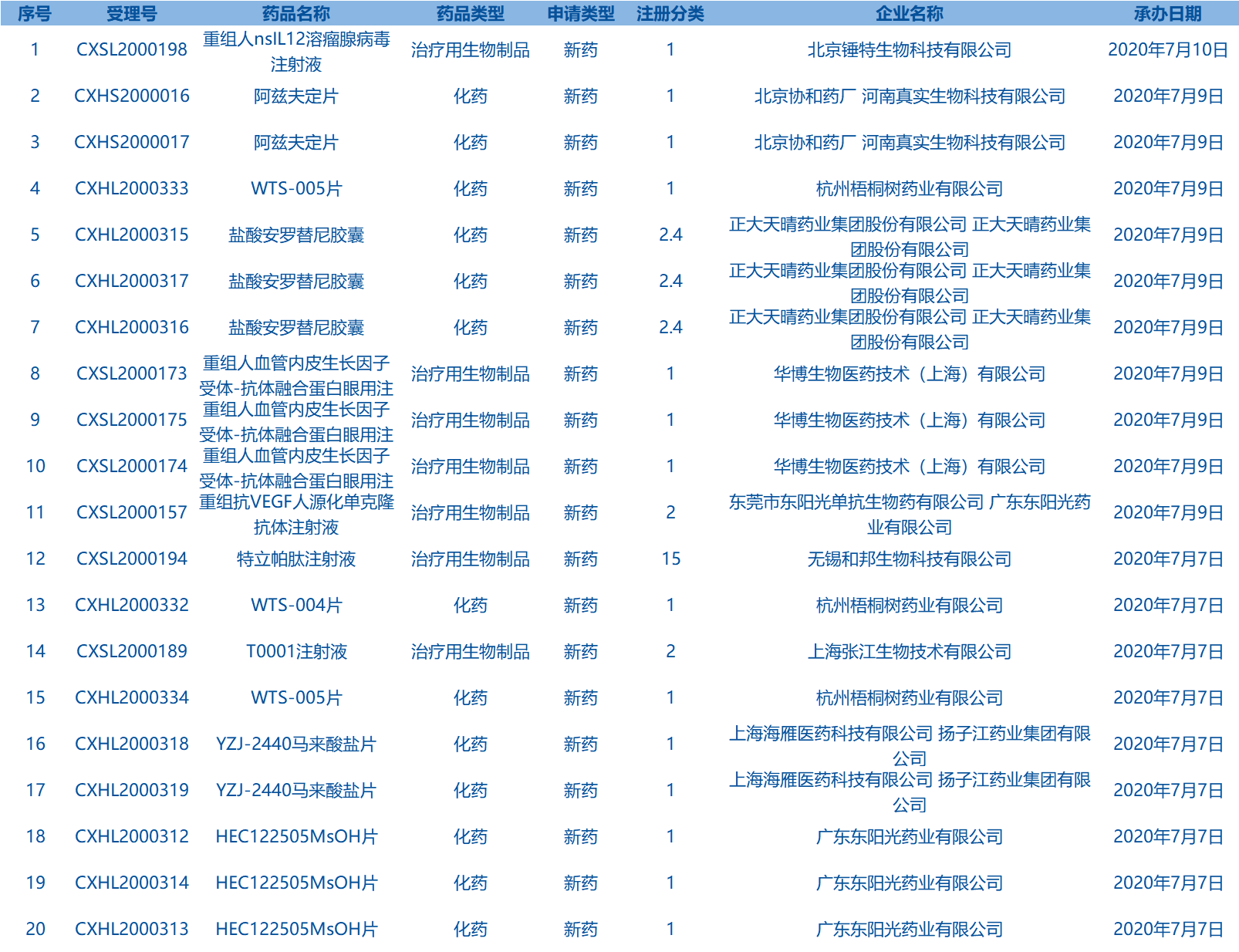
5.CDE网站信息显示,美泊利单抗注射液等3个药品进入拟优先审评审批程序。

6.国家药监局发布2020年06月进口第一类医疗器械产品备案信息,涉及一次性使用微量采血吸管等97个产品。
具体产品信息可查看链接http://www.nmpa.gov.cn/WS04/CL2176/378579.html。
7.国家药监局公布中药品种保护受理信息,受理吉林亚泰制药股份有限公司对参一胶囊的续保申请。
医药企业观察
1.海南葫芦娃药业集团股份有限公司将在上海证券交易所挂牌上市,此次公开发行股票数量为4010万股,发行价格为5.19元/股,募集资金总额为20811.9万元人民币。
2.三生国健药业(上海)股份有限公司发布首次公开发行股票并在科创板上市发行公告,称在初步询价结束后,公司确定此次科创板IPO的发行价格为28.18元/股,并将于7月13日开始进行网上和网下申购。
3.江苏恒瑞医药发布公告,子公司上海恒瑞医药有限公司出资6000万人民币,关联自然人、公司实际控制人孙飘扬先生出资4000万人民币,共同成立新公司瑞利迪(上海)生物医药有限公司(瑞利迪)。
4.再鼎医药宣布,与抗癌药物研发公司Turning Point Therapeutics就一款处于研究中的新一代酪氨酸激酶抑制剂Repotrectinib达成授权许可协议。根据协议,再鼎医药将获得Repotrectinib在大中华区的独家开发和商业化权利。
5.步长制药发布公告称,公司审议通过了《关于公司拟转让控股子公司股权的议案》,同意将控股子公司湖北步长九州通医药有限公司51%股权以2175.23万元人民币的价格转让给九州通医药集团股份有限公司。
6.平安好医生与勃林格殷格翰签署合作协议,双方将携手打造中国首个线上慢阻肺全方位管理项目。合作的具体内容包括:线上诊疗、处方、药品复购、配送,以及为患者提供医学咨询、科普教育、疾病管理等多个方面。
7.誉衡药业发布公告称,公司控股股东誉衡集团的债权人以誉衡集团无法清偿到期债务且资产不足以清偿全部债务为由,向黑龙江省哈尔滨市中级人民法院申请对誉衡集团进行破产重整。
8.亚盛医药发布公告称,公司与默沙东建立全球临床研究合作伙伴关系。双方将就亚盛医药在研原创MDM2-p53抑制剂APG-115与默沙东的PD-1单抗KEYTRUDA(帕博利珠单抗)的联合治疗展开临床研究,以评估该联合用药在晚期实体瘤患者中的临床效果。
9.诺辉健康宣布完成3000万美元E轮融资,本轮融资将用于巩固夯实诺辉健康旗下主力癌症早筛产品的规模扩张,加速新产品的研发、临床研究及市场转化。截至目前,诺辉健康多次获得全球知名风险投资、顶级生物医疗基金和长线投资机构的持续关注,投资总金额逾1.6亿美元。
10.成都倍特药业股份有限公司在创业板IPO上市申请已获深交所受理。成都倍特首次公开发行股票并在创业板上市招股说明书。
11.健康元药业集团股份有限公司发布公告称,公司拟非公开发行股票, 募集资金总额预计不超过 217276.05万元,发行股份不超过 169350000 股(含 169350000 股),本次非公开发行拟引入高瓴资本管理有限公司作为战略投资者,高瓴资本拟以其管理的“高瓴资本管理有限公司-中国价值基金”认购健康元2020年度非公开发行的全部股票。
药品集中采购
1.河北省医保局发布《关于进一步加强集中采购工作管理及有关问题的通知》。通知明确,河北省医保局对全省集中采购工作进行统筹规划,避免集中采购工作中“地方打架”“品种打架”问题的发生。地级市、省直管县、雄安新区医疗保障部门开展的药品、医用耗材带量采购、限价采购等集中采购需提前报河北省医保局审核;形成的采购目录、采购方案、采购文件等经河北省医保局审定后方可公布。
2.内蒙古自治区医保局通报了2020年第一季度全区药品集中采购考核情况,共有22家生产药企因有采购订单但未供货、31家配送药企因有采购订单未配送、16家三级医院因药品备案通过三个月未开展采购被通报批评。被通报批评的生产企业须于2020年7月17日前进行资料澄清,逾期未澄清的暂停企业交易资格。
3.广西壮族自治区医保局、自治区卫健委联合印发《关于进一步规范医疗机构药品备案采购工作的通知》,通知明确,公立医疗机构年度备案采购药品总品种数、采购总金额,均不得超过该医疗机构年度全部药品采购总品种数、采购总金额的5%。限额比例将随自治区药品集中采购相关政策变化予以调整。(中国食品药品网综合整理/李硕)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:李硕)
分享至
右键点击另存二维码!
-
为你推荐