2020盘点:美国FDA共召回注射剂110例
- 2021-01-15 16:14
- 作者:
- 来源:中国食品药品网
美国是全球最早诞生产品召回制度的国家。美国对药品召回(Recall)的定义是企业对市场上销售的有缺陷产品的撤回(removal)或更正(correction),召回的类型主要有企业自愿召回、FDA要求召回和强制召回。
《美国联邦法规》(英文简称是CFR)的第21章的7(C)部分为产品的自愿召回提供了一般性指导。另外,美国FDA在2003年11月3日发布的技术指南《产品召回指南(包括撤市和更正)》(Guidance for Industry: Product Recalls, Including Removals and Corrections)涵盖了更具体的建议,且适用于所有FDA监管产品的自愿和强制召回工作。
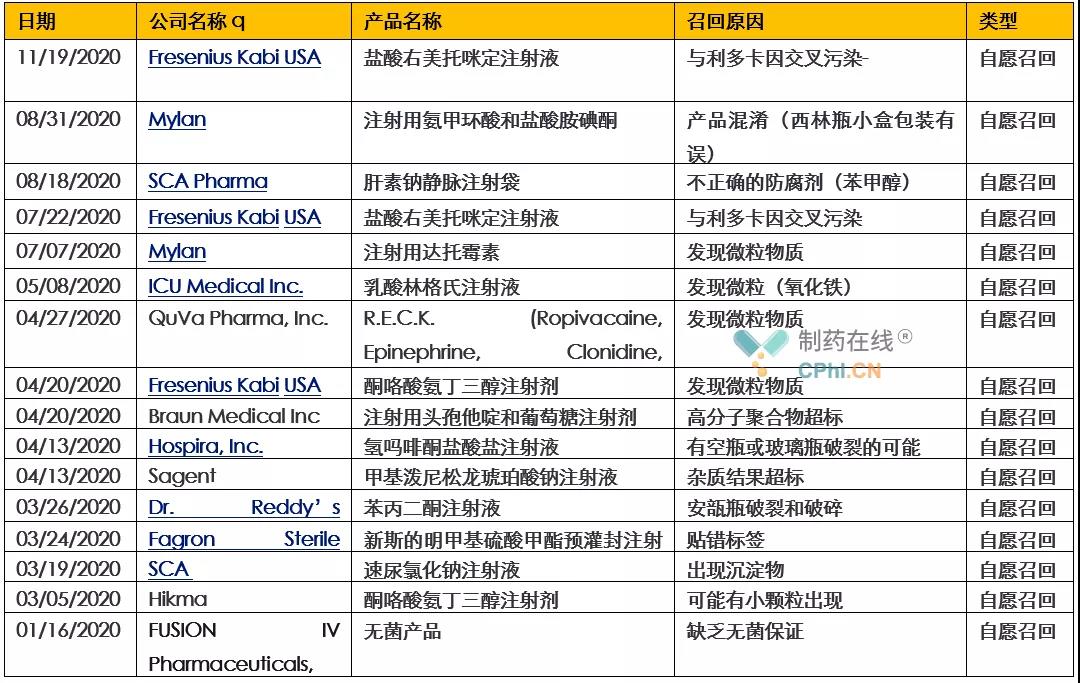
根据美国FDA官网公布的数据,据不完全统计,2020年FDA共召回药品110例,医疗器械18例。以下重点汇总和分析2020年度的注射剂召回情况。
2020年美国FDA官网公布16起注射剂召回事件,均为自愿召回。导致这些产品召回的原因涉及交叉污染、产品混淆、防腐剂使用不当、发现微粒物质、高分子聚合物超标、杂质超标、空瓶或可能玻璃瓶破裂、贴错标签、安瓿瓶破裂、出现沉淀以及缺乏无菌保证导致所有无菌产品召回等(详见表1)。
表1- 2020年FDA的注射剂产品召回事件
典型案例分析
案例1-由于交叉污染导致的产品召回
2020年费森尤斯卡比(Fresenius Kabi)共有3次召回事件,其中2020年7月22日和2020年11月19日的产品召回均是由于注射剂产品( 盐酸右美托咪定)被另外一种活性成分(利多卡因)污染。该公司曾在2019年底被国家药监局警告,并导致百济神州召回一款在我国市场销售的产品。
案例2-由于产品包装混淆导致的产品召回
2020年迈兰制药(Mylan)共有2次召回事件,其中2020年8月的产品召回原因是由于在小盒包装中存在注射用氨甲环酸和盐酸胺碘酮这两种注射剂的西林瓶发生了相互混淆。
另一起类似的召回事件发生在Fagron Sterile Services公司,2020年3月24日,该公司产品由于新斯的明甲基硫酸甲酯预灌封注射液的标签贴错被召回。
案例3-由于发现微粒物质导致的召回
2020年由于微粒物质导致的召回事件共5次,其中包括费森尤斯卡比(Fresenius Kabi)的酮咯酸氨丁三醇注射剂召回以及迈兰制药(Mylan)的注射用达托霉素召回等。如果静脉注射剂含有可见颗粒的溶液,可能会导致严重的不良事件,包括但不限于局部刺激、血管炎/静脉炎、抗原性或过敏性反应以及微血管阻塞,如肺栓塞。发生这样严重的事件,说明生产这些药品的企业在硬件和软件方面都存在明显的缺陷,也体现了质量体系的运行不佳。
案例4-由于防腐剂使用不当导致的召回
2020年8月,SCA制药的产品召回是由于其肝素钠产品中包含未声明的防腐剂苯甲醇。该产品标签上列出的防腐剂为对羟基苯甲酸甲酯和对羟基苯甲酸丙酯,不包含防腐剂苯甲醇。但事实是,这些批次产品中存在的防腐剂苯甲醇与标签不一致。这是SCA制药在对产品低含量偏差调查的过程中发现的。可以推测,这个偏差的发生应该和不同种类产品之间的不良清洁操作有关。
案例5-由于结果超标导致的召回
2020年4月13日发生在Sagent Pharmaceuticals公司的甲基泼尼松龙琥珀酸钠注射液召回是由于杂质超标;另外2020年4月20日Braun Medical Inc公司注射用头孢他啶和葡萄糖注射剂的召回是由于高分子聚合物超标。这个案例给制药行业从业者带来警示,这些产品很可能使用了不良的API,或发生了不期望的原辅料不相容的事件。
案例6-由于缺乏无菌保证导致的所有产品的召回
2020年1月FUSION IV Pharmaceuticals, Inc dba. AXIA Pharmaceutcal公司发生的召回,是由于该公司的无菌保证水平出现问题导致大规模的无菌产品被召回。这个案例所包含的产品和批次很多,可以推测该公司的质量控制体系基本失控,才会导致大面积的恶性事件发生。
案例7-某公司产品召回导致的其他公司产品连锁召回
2020年4月,QuVa Pharma, Inc.公司召回复合预灌封注射剂产品R.E.C.K. (Ropivacaine, Epinephrine, Clonidine, Ketorolac),是由于费森尤斯卡比(Fresenius Kabi)的酮咯酸氨丁三醇注射剂出现微粒物质召回引起的连锁反应。该产品为复合产品,其中的Ketorolac(酮咯酸氨丁三醇)是由费森尤斯卡比(Fresenius Kabi)制备。可见综合评估、仔细选择受托生产企业多么重要。
由此可见,在传统药品制造领域,美国制药行业的优势并不明显。随着我国新修订《药品管理法》的实施,以及《药品召回管理办法》的修订,我国制药企业面临的合规压力也非常大。希望国内企业结合以上案例,充分评估自己的产品和管理的不足,持续提高质量与合规水平,确保运营安全。(药智网)
说明:本文不构成任何投资判断和参考。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐












