他山之石·纳米材料③|有关纳米材料的安全注意事项
- 2021-02-04 17:55
- 作者:刘杵胜 苏哲 张海元 王晓炜 王钢力
- 来源:中国食品药品网
大量研究表明,某些纳米材料在物理化学性质、与生物系统的相互作用和/或毒理作用方面与对应的常规材料存在明显区别。例如,小尺寸的纳米颗粒可能穿透生物膜屏障,而这些生物膜屏障通常可以阻止较大颗粒物进入细胞和组织。因此,一旦材料以纳米颗粒的形式被人体摄入,某些不溶或难溶物质就可能到达一般较大尺寸颗粒物无法进入的身体部位。当颗粒尺寸降至纳米级时可能伴随着某些特定的物理化学性质改变,因此对拟用于化妆品的纳米材料进行详细表征显得尤为重要。纳米材料的表征不仅有利于正确鉴定其化学组成,而且有助于了解在安全评估中需要考虑的与颗粒相关的其他属性。
运用常规评估模式需考虑纳米特性
化妆品中使用纳米材料所引发的安全顾虑主要源于使用此类产品是否会导致消费者对纳米颗粒的局部和系统暴露、局部和/或系统的有害作用,以及总体的影响及由暴露引起的消费者健康风险问题。
大量研究和报告调查了可能存在的监管空白,得出的结论是:目前用于常规材料的风险评估模式也适用于纳米材料的风险评估。目前,常规材料是基于普通化学物质的结构化毒理学评价实现其危害识别与剂量反应关系特征描述,该方法也应适用于测定或描述纳米材料的毒性作用,前提是在测试过程中充分考虑纳米相关特性。
化学品的常规风险评估方法需同时考虑危害和暴露——二者缺其一则意味着该化学品对消费者不构成风险。因此,在化妆品纳米原料的安全评估中,可以首先考虑暴露因素,同时关注其在纳米尺寸展现的任何独特性质(参见图1,同时结合纳米材料表征的关键参数)。当然,这种方法需要对纳米材料进行详细表征,并确定系统暴露的可能性以及程度,当纳米材料经暴露途径并突破皮肤、呼吸道或胃肠道屏障发生转运时,可能导致系统暴露。此外,无论使用含纳米材料化妆品是否导致系统暴露,都应考虑其局部作用。即使未发现以纳米材料形式存在的系统利用度(systemic availability),或者未观察到局部作用,也需要对该化学物质是否存在转运以及是否引发系统作用进行评估。应按照欧盟消费者安全科学委员会(SCCS)指南(SCCS/1602/18或更新版本)完成对纳米材料化学物质本身的安全评估。对于施用于皮肤的含纳米材料化妆品,还应评估其光催化活性。
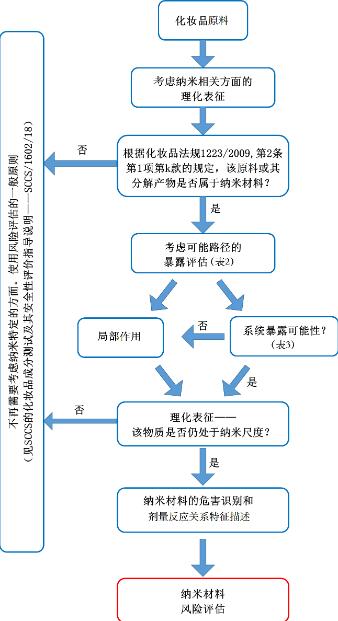
图1化妆品纳米材料安全评估示意图
如前所述,由于纳米级的尺寸及潜在的摄入和生物动力学改变,某些不溶或难溶的纳米颗粒能够穿透生物膜屏障进入常规颗粒难以进入的身体部位,进而对消费者构成健康风险。虽然已有研究观察到纳米材料向次级器官的转运,但是尚不清楚这些被认为低毒害或表面无毒害的纳米材料蓄积现象是否同样能够引发毒理学作用,和/或长期积累是否引起器官的病理变化。某种纳米材料的摄入机制也可能因其作用细胞类型和暴露途径不同而存在差异。目前,对纳米材料与生物体相互作用机制的了解仍相当欠缺,这种相互作用可能是达到分子水平或接近分子水平。当有证据表明纳米颗粒存在系统利用度时,需要进一步研究危害识别和剂量反应关系特征描述,过程中需考虑其纳米特性。
开发体内试验的替代方法
对于纳米材料,需要特别关注它的吸收、分布、代谢、排泄(ADME)参数测定。这些参数在过去通过体内试验测定。然而,《欧盟化妆品法规1223/2009》已经全面禁止了化妆品及其原料的体内试验(即动物实验,下同)以及相关产品的上市销售。自2004年9月、2009年3月起,通过体内试验获取化妆品产品、化妆品原料安全性数据的行为在欧盟相继被禁止,但皮肤致敏性、重复剂量毒性、毒物动力学和生殖毒性除外(需在欧盟以外进行实验)。随后,2013年3月开始,禁止所有毒理学终点的体内试验。因此,只有在这些截止日期之前获取的数据才能用于化妆品及其成分的安全评估。欧盟旨在推进符合3R原则〔Reduction(减少)、Replacement(替代)、Refinement(优化) 〕的替代方法的开发和验证,减少动物使用、减少动物痛苦或避免使用任何动物,同时确保与采用动物实验相当的安全水平。由于禁令,开发非动物的替代方法对于化妆品原料/终产品的安全评估十分重要,因为禁令生效后,化妆品及其原料的安全评估数据只允许通过替代方法获取,这意味着3R实际上仅限于1R(即,Replacement of animal testing,动物实验替代)。鉴于法规所颁布的试验和销售禁令,SCCS会考虑所有可用的科学数据,包括所被评估化合物的理化特性,计算机模拟数据,例如(Q)SAR{(定量)构效关系}建模、化学分类、分组、交叉参照(read-across)、生理药代动力学(PBPK)/生理毒物动力学(PBTK)建模,以及体外或离体实验结果。但如果纳米材料的体内数据是在禁令之前获得,或其体内研究数据是为了满足其他(非化妆品)法规要求而获取,例如药物或食品原料、杀虫剂或杀菌剂、按照REACH法规(欧盟,2008年)管理的工业化学品。如果有证据可以证明这些数据是在禁令之前获得,或是按照其他法规要求用于非化妆品而产生,则可以用于拟作为化妆品原料的纳米材料的安全评估。如果存在此类数据,则应将其归入化妆品原料安全档案一并提交。
尽管对现有体内试验方法进行了部分优化或减少,并开发了一批替代方法,但目前已经过验证的替代方法仅覆盖了安全评估中的部分毒理学终点。并且,大多数基于替代方法获取的数据/信息都是与危害识别相关。当前已通过验证且可用于常规化学品的体外方法主要涉及皮肤腐蚀性、皮肤刺激性、皮肤致敏性、眼刺激性、致突变性/基因毒性和光毒性。对于生殖毒性,目前已有3种替代方法通过验证,但由于其缺乏特异性,尚未被监管采纳。对于致癌性,最近通过验证的体外细胞转化试验(cell transformation assays,CTAs)有希望能够预测纳米材料诱导的细胞转化,而细胞转化是致癌性的关键终点之一。由于各种原因,包括脊椎动物的复杂性,目前尚无可用于重复剂量毒性(包括生殖毒性、发育毒性和致癌性)的有效体外方法,也没有处于预验证/验证阶段的相关方法。
需注意的是,目前可用于常规化学物质且经过验证的替代方法均未通过用于纳米材料的相关验证。另外,除了测试皮肤吸收以外,当前可用的体外测试方法无法用于潜在体内有害作用的剂量反应关系特征描述(SCCP 2007;SCCS 2009;Adler et al.2011;JRC report 2016,2017,2018)。这意味着,基于替代方法的化妆品纳米材料的定量风险评估目前仍然存在困难。但这种情况并非只出现在纳米材料的评估中,同样也存在于常规化妆品原料的评估中。尽管存在这些限制,体外方法用于纳米材料时还需额外考虑颗粒性质及其他纳米尺寸特性,并且测试方法也可能需要某些特定的改进或进一步的描述和验证。这些问题将在第5节中详细讨论。
在动物实验禁令的影响下,化妆品纳米材料的安全评估可以暴露场景和暴露相关考虑为导向(见图1),同时关注纳米材料的详细表征,并在毒理学评估过程中考虑纳米特性相关问题。由于目前缺乏已对纳米材料通过验证的替代方法,SCCS同样考虑未通过正式验证、但可以被证明科学有效的方法所获得的数据。
纳米材料毒理学研究的关注点
在毒理学研究方面需尤其注意的是,纳米材料与生物系统的相互作用可能有别于同种材料的常规形态。其中的某些作用可能导致纳米材料进一步的物理化学特性改变。蛋白质等分子附着在纳米材料表面形成“蛋白冠”就是其中一个典型的例子。因此,研究人员也应关注纳米材料在毒理学研究过程中发生的任何物理化学性质改变。需考虑的关键参数包括纳米尺寸(大小、形态、表面积)、团聚/聚集行为、颗粒的表面性质等。
本节给出了纳米材料安全评估的流程示意图(图1)。由于材料在纳米尺寸可能发生性质变化,因此详细的理化表征对于纳米材料的安全评估至关重要。
如果在测试过程中已经充分考虑了纳米相关特性,则目前用于常规化学品的危害识别/剂量反应关系特征描述等策略也应适用于纳米材料。纳米材料的安全评估应考虑纳米颗粒的局部和系统暴露、局部和系统有害作用以及由这种暴露引起的消费者健康风险。
纳米材料的安全评估应首先考虑暴露因素,同时关注其在纳米尺寸的特性。即使不存在纳米材料的系统吸收、和/或局部作用,也应按照SCCS指南(SCCS/1602/18或更新版本)将纳米材料作为化学品进行安全评估。当有证据表明纳米颗粒存在系统利用度时,需进一步结合其纳米特性完成危害识别和剂量反应关系特征描述。对于系统可及的纳米材料,需特别关注其吸收、分布、代谢、排泄(ADME)参数测定。
自2013年3月起,《化妆品法规1223/2009》明确禁止了化妆品及其原料的体内测试试验和基于此的化妆品上市销售。因此,毒理学数据需要源自已验证或科学可靠的替代方法,比如体外和离体方法、计算机模拟、化学分组和交叉参照、基于生理学的药代动力学和毒理动力学模型等。
只有在动物实验禁令生效之前或按照其他法规要求(即非化妆品用途)所获取的动物实验数据才能被视作合规数据。
本文翻译自《化妆品中纳米材料安全评估指南》——欧盟消费者安全科学委员会(2019年10月版)“有关纳米材料的安全注意事项”
(深圳市药品检验研究院 刘杵胜,王晓炜;中国食品药品检定研究院化妆品安全技术评价中心 苏哲,王钢力;中国科学院长春应用化学研究所 张海元)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:姜秀平)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













