注射剂一致性评价|多发补!注射剂过量灌装和可抽取体积仍需关注
- 2021-02-26 14:34
- 作者:
- 来源:新领先
2020年5月14日,国家药品监督管理局发布关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告,正式启动化学药品注射剂仿制药一致性评价工作。目前,不少企业获得了注射剂一致性评价批件,还有很多企业拿到了一致性评价发补意见。在发补意见中有很多是共性问题,其中注射剂过量灌装和可抽取体积研究尤为典型。对于注射剂过量灌装和可抽取体积应如何开展研究,国内并无明确的指导原则。因此,探索合理的符合技术及法规要求的研究策略十分重要。
常见发补意见
A项目
依据《化学药品注射剂仿制药质量和疗效一致性评价技术要求》,需对参比制剂的过量分装情况进行充分研究(采用将供试品溶解并全量转移至容量瓶定容的方法),如参比制剂存在过量灌装,仿制药的过量灌装宜与参比制剂保持一致,如不一致需提供合理性论证。
B项目
请按照本品说明书描述的临床使用方法,提供本品复溶溶液的可抽取体积以及浓度测定结果(保留至小数点后一位),需保证本品复溶溶液的浓度与说明书描述相同(100mg/ml),可抽取的API不低于标示量,必要时考虑对灌装量进行调整。
常见问题
发补意见比较明确,但具体开展研究工作时,可能面临以下问题:
如何判断参比制剂是否存在过量灌装?参比制剂的含量过量多少可判定为过量灌装?如整瓶溶解检测出参比制剂的含量,三个批次的含量分别为100.5%、102.0%、102.5%,参比制剂的含量标准为95.0%-105.0%,这种情况是否判定为过量灌装,过量灌装多少?
可抽取体积与过量灌装之间是何种关系?可抽取体积能否作为过量灌装量判定的依据?
法规要求
为了解答以上问题,笔者调研了国内外的相关法规和实际案例,首先是国内外相关法规。
〔1〕USP General Chapter<1>: Each container of an injectable product is filled with a volume that slightly exceeds the content indicated in the labeling.
注射剂产品每个容器中的灌装体积应略超过标签的标示量。
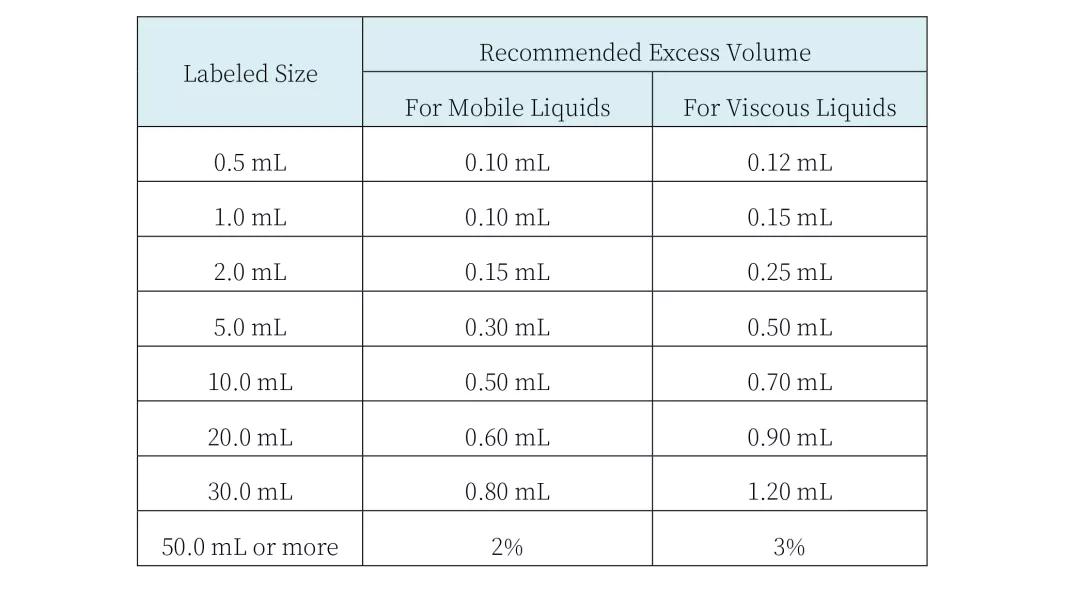
〔2〕USP General Chapter<1151>: Each container of an injection is filled with a volume in slight excess of the labled “size” or the volume that is to be withdrawn. The excess volumes recommended in the accompanying table are usually sufficient to permit withdrawal and administration of the labeled volumes.
附表中推荐的过量灌装体积通常足以允许抽提和管理标示量:
〔3〕美国FDA指导原则《Allowable Excess Volume and Labeled Vial Fill Size in Injectable Drug and Biological Products Guidance for Industry》规定:
In the case of drug products requiring reconstitution, the product should be designed to meet the label claim and acceptable overfill, and allow for correct dosing.
即粉针剂的装量应符合标示量要求和可接受的过量,并允许正确的剂量。
Allowable excess volume may also be referred to as “overfill,” but should not be confused with “overage,” which is addressed in a separate guidance.
overfill为过量灌装,overage为过量投料,本文讨论的是overfill,不要与overage混淆。
Generally, an applicant should not declare the amount of overfill on the container label.
通常,申请人不应在包装标签上注明过量灌装量。
The excess volume included in a drug product should be described in the common technical document (CTD) section 3.2.P.1, Description and Composition of the Drug Product.
过量灌装量需要在CTD资料3.2.P.1中描述。
The studies and justification (i.e., extractable volume testing, viscosity studies, fill volume variability) should be described in CTD section 3.2.P.2.2.1, Formulation Development and/or 3.2.P.2.3, Manufacturing Process Development.
可抽取体积、黏度、灌装体积变化等研究需要在CTD资料3.2.P.2.2.1(制剂研究)和3.2.P.2.3(生产工艺开发)中描述。
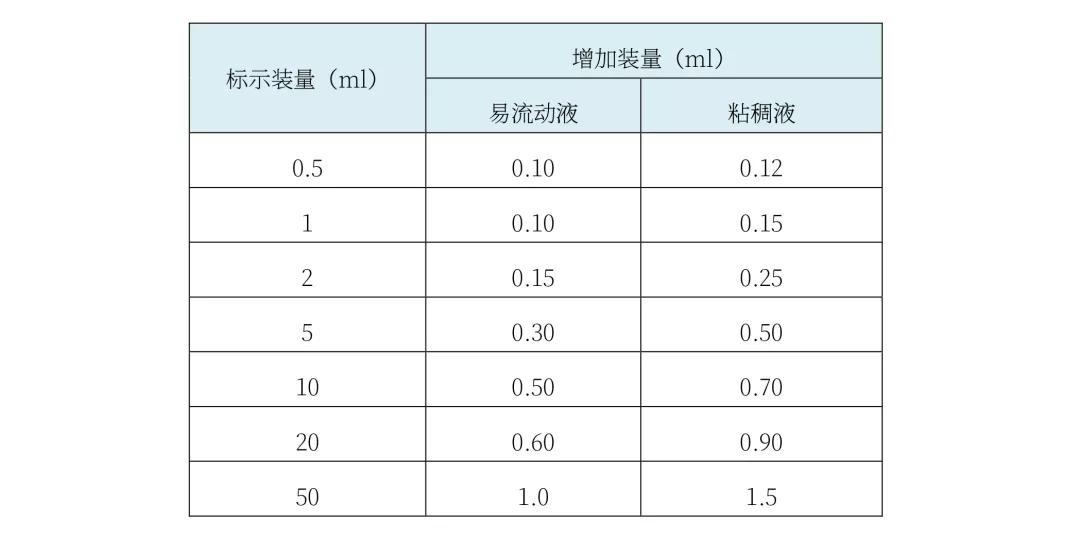
Chp2020版通则<0102>关于注射剂过量灌装体积的规定与USP基本一致:注射剂的灌装标示量不大于50ml时,可参考下表适当增加装量。
过量灌装案例分析
有不少原研制剂的审评综述中已明确说明进行了过量灌装,代表性的案例如下:
项目1
AVYCAZ (ceftazidime and avibactam) for injection

FDA审评报告明确本品存在过量灌装(overfill),account for the extractable volume from the reconstituted vial(目的是使复溶后可抽取体积满足要求),根据FDA提供数据,计算头孢他啶和阿维巴坦过量灌装量约为2%。
项目2
Bivalirudin for injection
欧洲审评报告明确本品过量灌装10%,A manufacturing filling overage of 10% is used during manufacture to ensure reaching of the target concentration。
另外,该品种进口注册标准含量限度为105.0%-115.0%,含量中值为110.0%,与欧洲审评报告过量灌装10%一致。
项目3
XXX无菌分装粉末,规格1.0g,按照临床使用方法,可采用3ml和10ml注射用水溶解,经考察,3ml时抽取损失量约为5%,10ml时抽取损失量约为2%。
此特殊情况下,过量灌装量应大于抽取损失量,以弥补临床使用抽取时的损失量。
结论
根据上述2个常见问题,结合国内外指导原则,得出以下结论:
为弥补注射剂(包括水针、粉针等)在临床使用时抽取的损失量,注射剂均需要进行过量灌装,故参比制剂原则上均存在过量灌装情况。
药液临床使用时抽取损失量,主要与药液的黏度、体积及包材内表面性质等直接相关,与抽取用的注射器也相关,可根据参比制剂整瓶复溶的含量、抽提试验的损失量,共同确定参比制剂的过量灌装量,即使过量灌装量较低(如2%),仍确定为过量灌装。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐












