每周医药看点(12.28—1.3)
- 2023-01-30 09:32
- 作者:刘思慧
- 来源:中国食品药品网
中国食品药品网讯 国家药监局发布《药品上市许可持有人落实药品质量安全主体责任监督管理规定》;第六十二批仿制药参比制剂目录发布……12月28日—1月3日,医药行业的这些动态值得关注。
行业政策动态
1.国家药监局发布《药品上市许可持有人落实药品质量安全主体责任监督管理规定》,自2023年3月1日起施行。《管理规定》梳理归纳了持有人企业负责人、生产管理负责人、质量管理负责人、质量受权人、药物警戒负责人等关键岗位人员的职责和资质要求,同时细化了持有人质量管理要求和机制,强调持有人应当建立药品追溯制度、药品召回制度、药物警戒制度、停产报告制度、年度报告制度等,首次提出季度分析工作机制,质量负责人应当结合产品风险定期组织对生产管理、质量管理等情况进行回顾分析,原则上每季度不少于一次对重复性风险和新出现风险进行研判,制定纠正预防措施,持续健全质量管理体系。
2.国家药监局发布关于实施《国家中药饮片炮制规范》有关事项的公告。公告明确,自实施之日起,生产《国家炮制规范》收载的中药饮片品种应当符合《中华人民共和国药典》和《国家炮制规范》的要求。《国家炮制规范》实施前已按原标准生产并符合相关规定的中药饮片可以在实施之后继续流通、使用。公告指出,各省级药品监督管理部门应当废止与《国家炮制规范》中品名、来源、炮制方法、规格均相同品种的省级中药饮片炮制规范。
3.国家药监局发布公告,决定对磷酸/盐酸川芎嗪注射及口服制剂(包括磷酸/盐酸川芎嗪注射液、磷酸/盐酸川芎嗪葡萄糖注射液、磷酸/盐酸川芎嗪氯化钠注射液、注射用磷酸/盐酸川芎嗪、磷酸川芎嗪片、磷酸川芎嗪滴丸、磷酸川芎嗪胶囊)说明书内容进行统一修订;决定对氢化泼尼松注射液、盐酸哌替啶注射液说明书内容进行统一修订。
4.国家药监局发布仿制药参比制剂目录(第六十二批),涉及波生坦分散片等药品。
5.国家知识产权局、国家医保局联合发布《关于加强医药集中采购领域知识产权保护的意见》。《意见》从建立协调机制、加强业务协作、加强工作保障等方面明确了各项措施,将具体开展建立会商机制、明确联络机构、加强信息共享、建立企业自主承诺制度、做好纠纷化解引导工作、加强协作制止侵权、分析研判重点产品、开展联合调研、开展业务培训、加强宣传引导等十个方面工作。下一步,国家知识产权局和国家医疗保障局将共同推进并指导地方知识产权管理部门和医疗保障部门开展加强医药集中采购领域知识产权保护工作,有力防范侵权行为发生,鼓励医药领域创新发展,优化营商环境。
6.国家药监局药品审评中心(CDE)公示化学仿制药参比制剂目录(第六十五批),涉及卡波姆滴眼液等药品。公示期为2022年12月29日—2023年1月11日。
7.CDE就《2型糖尿病口服药物复方制剂研发指导原则(征求意见稿)》公开征求意见,征求意见稿在《复方药物临床试验技术指导原则》的基础上,基于糖尿病疾病特征、治疗理念和临床实践情况,结合2型糖尿病复方降糖药物的特点以及研发需关注的问题提供建议。征求意见截止日期为2023年2月2日。
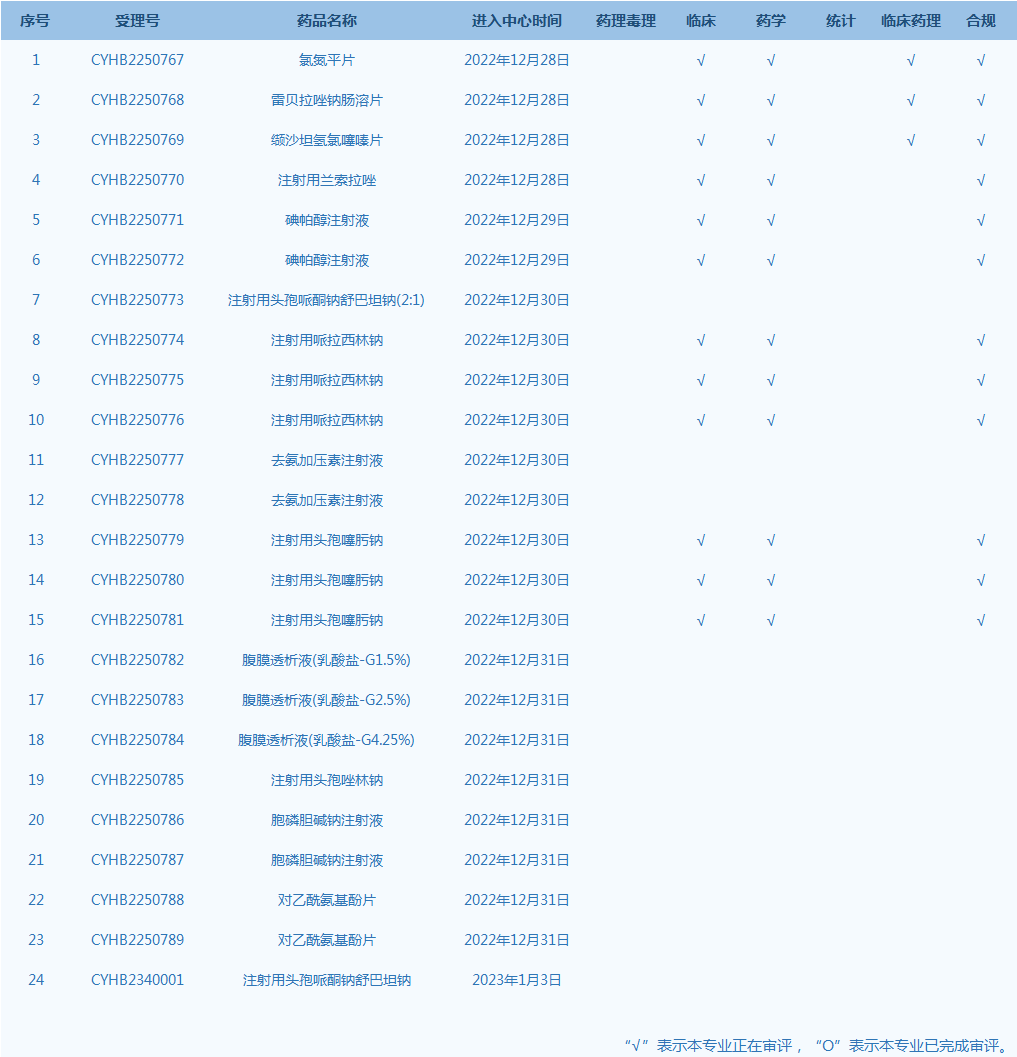
8.CDE网站公示24个仿制药一致性评价任务,涉及氯氮平片等药品。(截至1月3日)
产品研发上市信息
1.国家药监局批准首个按古代经典名方目录管理的中药复方制剂(即中药3.1类新药)苓桂术甘颗粒上市。该药品处方来源于汉·张仲景《金匮要略》,已列入《古代经典名方目录(第一批)》,药品上市许可持有人为江苏康缘药业股份有限公司。
2.国家药监局通过快速审评通道,批准对乙酰氨基酚维生素C泡腾片等13个新冠病毒感染对症治疗药物上市。获批品种中9个品种为国家卫生健康委发布的《新冠病毒感染者居家治疗指南》中推荐的常用对症治疗药物,4个品种为医用氧。
3.国家药监局附条件批准默沙东公司新冠病毒治疗药物莫诺拉韦胶囊(商品名称:利卓瑞/LAGEVRIO)进口注册。本品为口服小分子新冠病毒治疗药物,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒感染(COVID-19)患者,例如伴有高龄、肥胖或超重、慢性肾脏疾病、糖尿病、严重心血管疾病、慢性阻塞性肺疾病、活动性癌症等重症高风险因素的患者。患者应在医师指导下严格按说明书用药。
4.国家药监局批准新疆华春生物药业股份有限公司申报的中药1.1类创新药参葛补肾胶囊上市。该药品益气、养阴、补肾,适用于轻、中度抑郁症中医辨证属气阴两虚、肾气不足证。
5.国家药监局批准了湖南安邦制药股份有限公司申报的中药新复方制剂芪胶调经颗粒上市。该药品由黄芪、阿胶、党参、白芍等9味药组方,具有益气补血、止血调经功效,用于上环所致经期延长中医辨证属气血两虚证。
6.国家药监局通过快速审评通道,批准布洛芬混悬液等12个新冠病毒感染对症治疗药物上市。获批品种均为国家卫生健康委发布的《新冠病毒感染者居家治疗指南》中推荐的常用对症治疗药物。
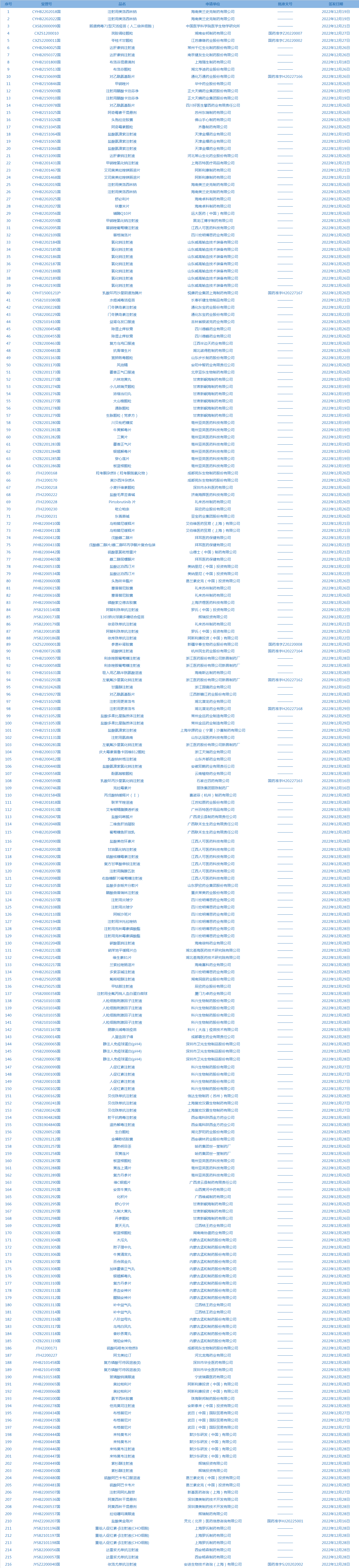
7.国家药监局发布4期药品批准证明文件送达信息,共包括216个受理号,涉及海南美兰史克制药有限公司等企业。(截至1月3日)
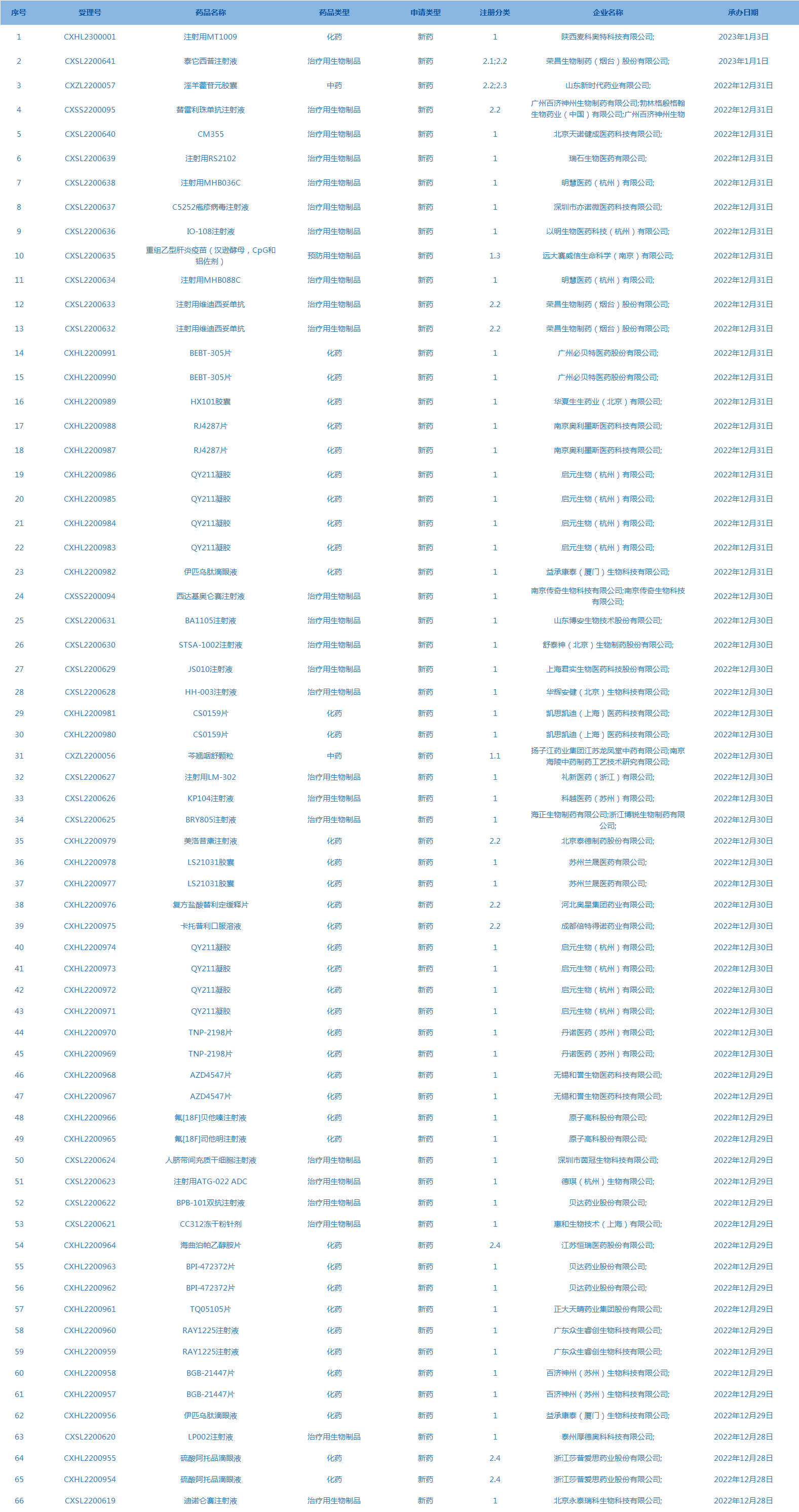
8.CDE承办受理66个新药上市申请,包括注射用MT1009等药品。(截至1月3日)
9.普利制药发布公告称,收到美国食品药品管理局(FDA)签发的盐酸多巴酚丁胺注射液批准通知;收到斯里兰卡国家药品监督管理局签发的注射用更昔洛韦的上市许可。
10.荣昌生物宣布,其自主研发的创新型抗体偶联药物(ADC)注射用RC108获得美国FDA临床试验许可,将在c-Met表达阳性的实体瘤患者中开展临床研究。
医药企业观察
1.博济医药与远大蜀阳签订《临床研究委托合同》,合同总金额为人民币5550万元(含税)。 合同约定了远大蜀阳委托博济医药完成治疗用生物制品3.3类药品“注射用SYB507”的Ⅲ期临床研究和相关工作。
2.赛升药业发布公告称,其子公司赛而生物与海晶生物签署《技术合作开发合同》,交易总额为1160万元。
3.博安生物于2022年12月30日正式在港交所上市。博安生物成立于2013年,主要针对肿瘤、代谢、自身免疫及眼科等疾病领域开发和商业化优质生物制品。
4.虹信生物宣布完成数千万元天使+轮融资。本轮融资由弘陶资本领投,海创药业和东宝实业集团战略投资,南岭基金、深圳担保集团、紫金港资本等跟投。本轮融资将用于该公司核心产品的临床开发以及团队扩建等。
5.易慕峰宣布完成A+轮近两亿元融资。本轮投资由国投创业领投,国生资本等跟投,募集资金主要用于加速推进该公司旗下IMC001、IMC002、IMC008等多个CAR-T产品的临床研究。
药品集中采购
1.广东省医保局发布《关于做好阿莫西林等45个药品中选产品第二采购年相关工作的通知》。通知指出,为保障目前疫情防控救治和群众用药需求,有关续签需求量的报量时间另行通知,医疗机构可先行与企业签订第二年购销合同,延期报量期间所产生的实际采购量计入第二采购年的协议采购量中。此外,将调整部分品种中选价格。按照采购文件约定的“量价挂钩”原则,首年未执行第2梯级报价(即P2)的产品,第二年续签采购协议时,此部分品种中选企业的实际采购量超过采购期首年预采购总量的,其续签价格需执行本企业P2报价,其他中选品种仍按原中选价格执行。
2.江苏省医保局发布《关于做好江苏省第三轮药品集中带量采购签约量填报和中选结果执行等工作的通知》,填报时间为2023年1月3日—1月9日17时。独家中选品种方面,要求医疗机构将同品种意向量的80%分配给该品种独家中选企业;非独家中选品种方面,要求确认优先采购量,医疗机构将同品种意向量的20%作为优先采购量,从优先量企业(价格最低的前50%)中任意选择一个或多个进行分配,填报的优先采购量折算成同品种最小规格量的总和,不得小于填报系统标明的最低量。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐













