2023年5月份中美欧批准上市新药盘点: 4款我国自主研发新药在全球范围内首次获批
- 2023-06-13 10:23
- 作者:陈倩
- 来源:中国医药报
5月份中美欧批准上市的新药中,中国批准上市新药数量超过美国和欧盟,且有4款为我国自主研发的新药。
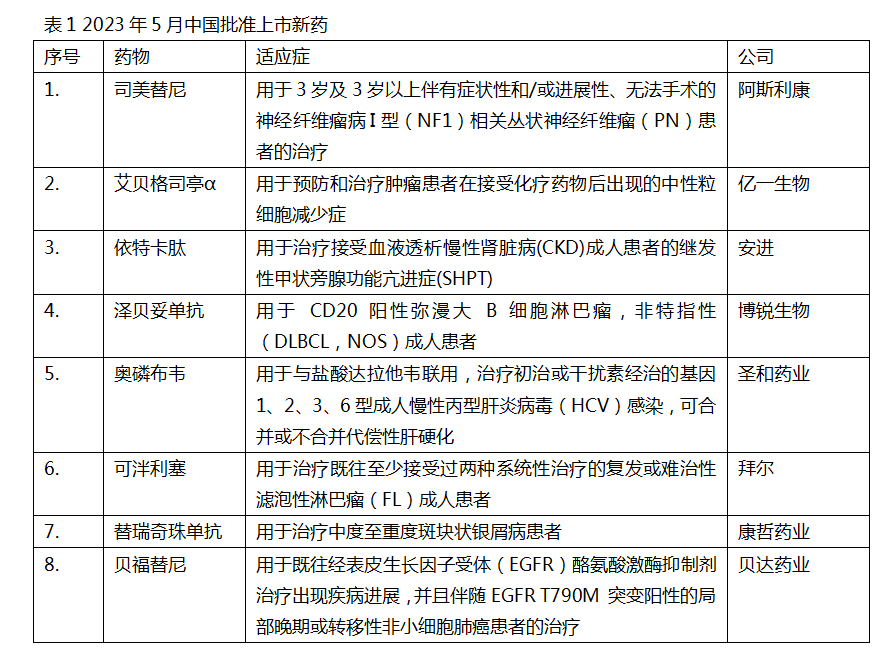
中国批准8款新药上市
2023年5月,我国批准8款新药上市。根据Pharmadigger数据库,艾贝格司亭α注射液、泽贝妥单抗注射液、奥磷布韦片、甲磺酸贝福替尼胶囊4款药物为我国自主研发并在全球范围内首次获批上市的新药。
艾贝格司亭α是亿一生物研发的重组人粒细胞集落刺激因子-Fc融合蛋白,是基于Fc融合蛋白技术,由CHO细胞表达的rhG-CSF二聚体,具有长效和强效的生物学特点。在中国完成的关键Ⅲ期临床试验结果显示,艾贝格司亭α治疗组的患者在4个化疗周期的中性粒细胞最低值显著高于非格司亭对照组。2021年 8 月,亿一生物以交易总额超过2.1亿元将艾贝格司亭α中国境内所有知识产权和商业化权益独家许可给正大天晴。
泽贝妥单抗是博锐生物研发的首款国产靶向CD20的抗体,可特异性结合B细胞表面的CD20抗原,从而启动B细胞溶解的免疫反应,发挥抗肿瘤作用。相比于其它同类CD20抗体,泽贝妥单抗介导的细胞毒性效应(ADCC)更强,同时具有更大的稳态分布容积,能够对B细胞产生更持久的清除作用,从而发挥更好的药物作用。该公司发布的各项研究结果表明,泽贝妥单抗相比于利妥昔单抗在结构上得到了进一步优化,从而具有更佳的抗肿瘤潜力。
奥磷布韦是圣和药业研发的一款丙肝病毒NS5B聚合酶抑制剂。作为一款核苷类前体药物,奥磷布韦可通过肝脏代谢,转化为具有抗病毒活性的非天然核苷三磷酸,进而可以与丙肝病毒复制所需的NS5B聚合酶发生竞争性结合,形成错误的病毒RNA模板,导致病毒RNA链的延长提前终止,丙肝病毒的复制也因此被终止。该药的Ⅲ期临床试验结果显示,奥磷布韦片联合盐酸达拉他韦片用于基因1、2、3、6型慢性丙型肝炎成人患者,患者治疗结束后12周时的持续病毒学应答率(SVR12)为98.5%。
贝福替尼是贝达药业开发的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)。本次获批是基于贝福替尼用于治疗接受一代或二代EGFR-TKI治疗后产生耐药且EGFRT790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者的单臂Ⅱ期临床试验。结果显示,独立评审委员会(IRC)评估的患者无进展生存期(PFS)为16.6个月,研究者评估的患者PFS为12.5个月。贝福替尼最初由益方生物研发,2018年12月,贝达药业与益方生物达成合作,获得了贝福替尼在中国的权益,并可独家在合作区域内进行该产品的开发及商业化。
司美替尼是阿斯利康和默沙东公司共同开发的MEK抑制剂。神经纤维瘤病Ⅰ型(NF1)是一种罕见、不可治愈的遗传性疾病,在新生儿中发病率约为1/3000。该疾病是因为合成神经纤维瘤蛋白的NF1基因发生突变引起,这种基因突变可扰乱RAS/MAPK信号通路进而导致肿瘤的生长。司美替尼能够选择性地抑制MEK1和MEK2,让失调的信号通路恢复正常,进而缓解NF1患儿的病情。此前FDA批准该药是基于一项Ⅱ期临床试验的结果。该试验共纳入50例患者,结果显示约2/3患者获得客观缓解。
依特卡肽是安进公司研发的一款新型钙敏感受体激动剂,通过调节甲状旁腺主细胞表面钙敏感受体分泌甲状旁腺激素(PTH)的作用,降低PTH水平。该药于2016年11月在欧盟获批,2017年2月在美国获批。慢性肾脏病(CKD)患者的继发性甲状旁腺功能亢进(SHPT)是指由CKD导致的甲状旁腺组织继发性增生、腺瘤形成及血清PTH水平升高,是CKD患者常见且严重影响患者预后及生活质量的并发症之一。
可泮利塞是拜耳公司研发的一款静脉注射的磷脂酰肌醇-3-激酶(PI3K)抑制剂,它能够在亚纳摩尔水平上抑制主要表达在恶性B细胞中的PI3K-α和PI3K-δ两种激酶亚型。本次获批是基于一项名为CHRONOS-1的单臂Ⅱ期临床试验,结果显示,在此前已经接受了至少两次治疗但病情依然出现复发的滤泡性淋巴瘤患者中,接受可泮利塞单药治疗的患者总缓解率(ORR)达59%,包括14%的完全缓解率(CR)。
替瑞奇珠单抗是康哲药业通过与Sun Phar ma合作引进的一款特异性靶向IL-23的新型单抗,能选择性地与IL-23的p19亚基结合,并抑制其与IL-23受体相互作用,从而抑制促炎症细胞因子和趋化因子的释放。在替瑞奇珠单抗用于中度至重度斑块状银屑病患者的Ⅲ期临床试验中,共入组220例患者,结果显示,与安慰剂相比,替瑞奇珠单抗治疗12周时可显著提高达到PASI 75(银屑病面积和严重程度指数较基线至少改善75%)的患者比例。
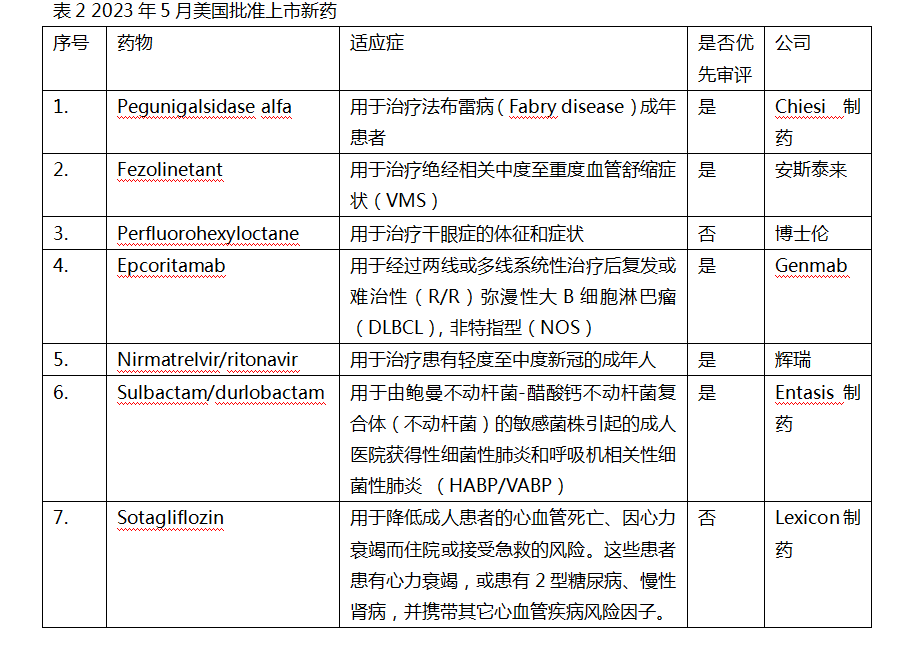
美国批准7款新药上市
5月份,美国批准上市7款新药。除Pegunigalsidase alfa于同月首先在欧盟获批外,其他均为全球首次批准。
Pegunigalsidase alfa(商品名:Elfabrio)是Protalix生物制药和Chiesi制药合作研发的一种聚乙二醇化酶替代疗法(ERT),用于治疗法布雷病成年患者。它是一种在植物细胞培养中表达的重组人α-半乳糖苷酶,具有更长的半衰期,仅需每两周注射一次。法布雷病是一种X连锁遗传性疾病,由溶酶体α-半乳糖苷酶活性不足导致酰基鞘氨醇三己糖苷(Gb3)的脂肪物质在全身血管壁中异常沉积积累而引起,Gb3在细胞中的堆积会对重要器官造成严重损害,包括肾脏、心脏、肠道和皮肤等。该药此次获批主要基于对超过140名ERT初治和经治患者进行的临床试验,其中一项与已上市的阿加糖酶-β进行头对头试验,结果显示该药在控制肾小球滤过率下降方面的疗效达到非劣效性标准,并且耐受性良好。该药于5月4日在欧盟首先获批上市。
Fezolinetant(商品名:Veozah)由安斯泰来研发,是FDA批准的首款用于治疗绝经相关中度至重度血管舒缩症状(VMS)的口服非激素疗法。这款口服选择性神经激肽3受体(NK3)拮抗剂,通过阻断NK3与Kisspeptin/神经激肽/强啡肽(KNDy)神经元的结合,调节大脑体温调节中枢(下丘脑)的神经元活动,降低绝经相关中重度VMS的频率和严重程度。VMS是最常见的更年期相关症状,常表现为潮热或盗汗。该药此次获批是基于名为BRIGHT SKY临床试验项目的结果。结果显示,相对于安慰剂组,患者使用Fezol inetant后能显著降低中度至重度血管舒缩症状的频率和严重程度。
Perfluorohexyloctane(商品名:Miebo)是博士伦研发的一种无色、透明的滴眼液,由100%全氟己基辛烷组成,能迅速扩散至整个眼表,并与泪膜的亲脂部分相互作用,覆盖在泪膜水液层表面,稳定泪膜,防止泪液过度蒸发。该药此次获批是基于两项名为GOBI和MOJAVE的Ⅲ期临床试验,试验纳入了干眼症病史和睑板腺功能障碍(MGD)的患者,结果显示,用药组第8周(第57±2天),患者总角膜荧光素染色(tCFS)和眼干的严重程度评分(VAS)与基线相比能显著降低。2019年11月,恒瑞医药从Novaliq公司引进该药物,获得其在中国的临床开发、生产和市场销售的独家权利。
Epcoritamab(商品名:Epkinly)是艾伯维和Genmab公司共同研发的首个且唯一获批的双特异性T细胞衔接器,将T细胞上的CD3和B细胞上的CD20同时结合,并诱导T细胞介导的对CD20+细胞的杀伤。弥漫性大B细胞淋巴瘤(DLBCL)是一种发病迅速且会产生耐药的侵袭性肿瘤。FDA此次批准是基于名为EPCORE NHL-1的Ⅰ/Ⅱ期临床试验,结果显示,148例CD20+DLBCL患者在使用该药单药治疗后,约2/3的患者获得疾病缓解,CR为38%,缓解中位时间为15.6个月。
Nirmatrelvir/ritonavir(商品名:Paxlovid)获FDA正式批准,为首款口服抗新冠病毒药,此前于2021年12月获FDA紧急使用授权。
Sulbactam/durlobactam(商品名:Xacduro)是Entasis制药研发的一款β-内酰胺类抗生素(Sulbactam)和β-内酰胺酶抑制剂(durlobactam)抗生素组合疗法,用于治疗不动杆菌的敏感菌株引起的成人医院获得性细菌性肺炎和呼吸机相关性细菌性肺炎。不动杆菌是一种革兰氏阴性细菌,是一种机会性人类病原体,主要感染免疫功能低下的危重患者,通常会导致严重的肺炎和血流感染。再鼎医药拥有该药在中国与亚洲其他国家和地区的开发和商业化的独家授权。
Sotagliflozin是Lexicon制药研发的双重抑制剂,同时靶向两种钠葡萄糖协同转运蛋白(SGLT1和SGLT2),这两种蛋白分别负责胃肠道和肾脏中的葡萄糖吸收。该药用于降低成人患者的心血管死亡、因心力衰竭而住院或接受急救的风险。FDA此次批准是基于两项Ⅲ期临床试验,试验结果均达到了各自的主要终点,且Sotagliflozin总体耐受性与安慰剂组相似。
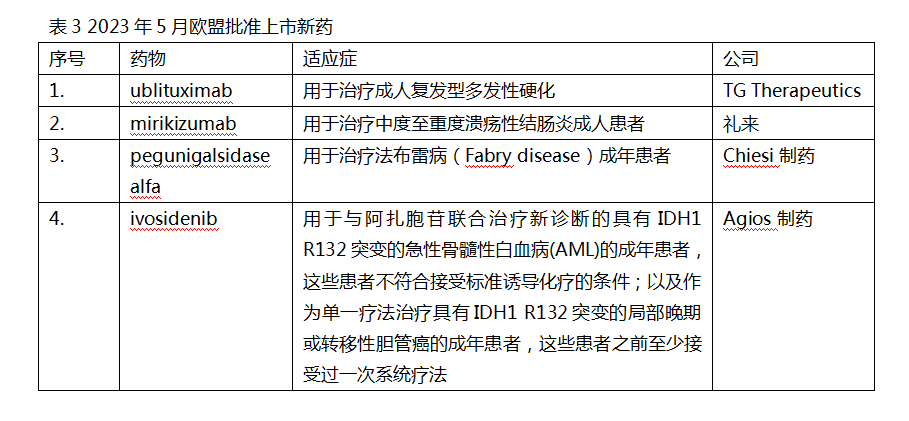
欧盟批准4款新药上市
2023年5月,欧盟批准了4款新药上市,Pegunigalsidase alfa为全球首次批准的新药。
Ublituximab(商品名:Briumvi)是一款由TG Therapeutics研发的靶向B细胞表达的CD20单抗。该药此次获批后成为目前美国和欧盟批准的首个也是唯一的治疗成人复发型多发性硬化的抗CD20单抗。欧盟此次批准基于ULTIMATEⅠ、Ⅱ两项Ⅲ期临床试验数据,结果显示,该药在显著降低年度复发率(ARR)方面优于对照组特立氟胺。
Mirikizumab由礼来研发,是一款IL-23p19抗体药物,可与IL-23的p19亚基结合,阻断IL-23介导的炎症反应,用于治疗中度至重度溃疡性结肠炎成人患者。该药此次获批是基于3项LUCENT系列Ⅲ期临床试验。其中LUCENT-1共入组了1162例既往未使用过生物制剂治疗和接受过一种生物制剂但治疗失败的溃疡性结肠炎患者,结果显示,与安慰剂相比,该药在12周时达到了临床缓解的主要终点。
Ivosidenib(商品名:Tibsovo)是Agios公司研发的一种靶向IDH1酶的口服抑制剂。欧盟此次批准该药的急性髓性白血病(AML)适应证主要基于一项名为AGILE的Ⅲ期临床试验。结果显示,Ivosidenib与阿扎胞苷联用,在无事件生存期(EFS)和OS方面,与阿扎胞苷加安慰剂组相比有统计意义的改善。欧盟批准该药IDH1 R132突变的胆管癌适应证主要基于名为ClarIDHy的Ⅲ期临床试验,该试验纳入了接受过一二线系统性治疗失败后的IDH1突变型胆管癌患者,结果显示,Ivosidenib与安慰剂相比PFS改善具有统计学意义。(陈倩)
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐