1月份中美欧批准上市新药盘点:两款我国自主研发的新药在全球范围内首次获批上市
- 2024-03-28 20:36
- 作者:陈倩
- 来源:中国医药报
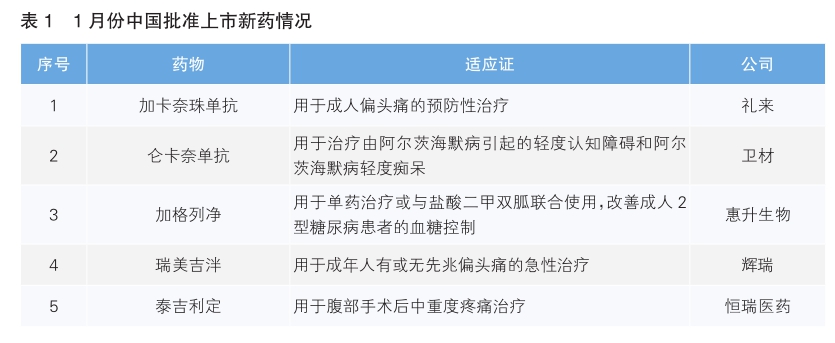
今年1月份中美欧批准上市的新药中,中国批准上市新药数量超过美国和欧盟。其中,加格列净、泰吉利定为我国自主研发的全球范围内首次获批上市的新药。
中国批准5款新药上市
1月份,我国批准了5款新药上市。根据Pharmadigger数据库,当月全球范围内首次获批上市新药为加格列净和泰吉利定(详见表1)。
加格列净为四环医药旗下惠升生物研发的一款葡萄糖钠协同转运蛋白2(SGLT-2)抑制剂,可作用于体内的SGLT-2转运蛋白,防止已滤过的葡萄糖在肾脏内重吸收,从而有效控制血糖水平。据四环医药公告,加格列净完成了两项Ⅲ期临床试验,分别为评估加格列净片单药治疗中国2型糖尿病患者有效性和安全性的临床研究,以及评估加格列净联合二甲双胍治疗2型糖尿病患者有效性和安全性的临床研究。结果显示,加格列净不仅具有较好的降糖效果,同时具有降低血压、减轻体重、改善血脂等多重疗效。
泰吉利定是恒瑞医药研发的一款靶向μ阿片受体(MOR)的小分子药物,与经典的MOR激动剂如吗啡、芬太尼等相比,泰吉利定可在产生类似的中枢镇痛作用的同时,降低常见的胃肠道不良反应发生率。该药本次获批是基于泰吉利定注射液对比吗啡或安慰剂用于患者腹部手术后镇痛的Ⅲ期临床试验。结果显示,泰吉利定注射液能够有效缓解腹部手术后中重度疼痛。
加卡奈珠单抗是礼来公司研发的一款人源化IgG4型单克隆抗体,可与降钙素基因相关肽(CGRP)结合并阻断CGRP与其受体结合,从而达到预防偏头痛的治疗目的。该药本次获批基于一项由中国发起、联合印度与俄罗斯共同参与的全球多中心Ⅲ期临床研究。结果显示,与全球已完成的主要研究结果有效性数据一致,与已知安全性特征一致。加卡奈珠单抗注射液此前于2018年9月在美国获批上市。
仑卡奈单抗是卫材和渤健公司研发的抗淀粉样蛋白(Aβ)原纤维抗体,它与可溶性Aβ聚合体结合,并且促进它们的清除,具有缓解疾病进展的潜力。在名为Clarity AD的Ⅲ期临床研究中,结果显示,在治疗18个月后,仑卡奈单抗治疗组与安慰剂组相比,患者临床痴呆评定总和量表评分(CDR-SB)衰退程度减缓27%。仑卡奈单抗此前已于2023年1月在美国获批上市。
瑞美吉泮是Biohaven公司研发的一款采用口崩片技术的降钙素基因相关肽(CGRP)受体拮抗剂,能够有效阻断偏头痛发病相关的关键通路,快速且持续缓解头痛及相关伴随症状,服用方式便捷。2022年5月,辉瑞斥资约116亿美元收购了Biohaven公司,从而获得这款药品。该药本次获批基于瑞美吉泮对比安慰剂用于治疗急性偏头痛的Ⅲ期临床研究。结果显示,患者单剂量口服75mg瑞美吉泮2小时后达到了疼痛和最困扰症状缓解的共同主要终点,患者可在45分钟内迅速缓解疼痛和消除最困扰症状,60分钟内恢复正常功能;对多数患者而言,其持续疗效可达48小时;安全性和耐受性与之前在美国的临床试验结果一致。瑞美吉泮此前于2020年2月在美国获批上市。
美国批准1款新药上市
1月份,美国批准1款新药Berdazimer上市,用于治疗成人和1岁及以上儿童传染性软疣患者。根据Pharmadigger数据库,该药为全球范围内首次获批上市。
Berdazimer(Zelsuvmi)是Ligand医药公司研发的一种用于治疗病毒性皮肤感染的局部抗病毒凝胶,是治疗这种具有高度传染性的病毒性皮肤感染的首个局部使用处方药。其活性成分Berdazimer可释放一氧化氮,具有广谱抗菌和抗病毒活性。传染性软疣是由传染性软疣病毒(MCV)引起的一种高度传染性的皮肤感染。感染者大部分是儿童和免疫功能低下的成年人。该药本次获批基于一项名为B-SIMPLE4的关键Ⅲ期临床研究。结果显示,Berdazimer治疗传染性软疣可获得统计学意义的显著改善,患者经过12周治疗后实现了病灶完全清除。
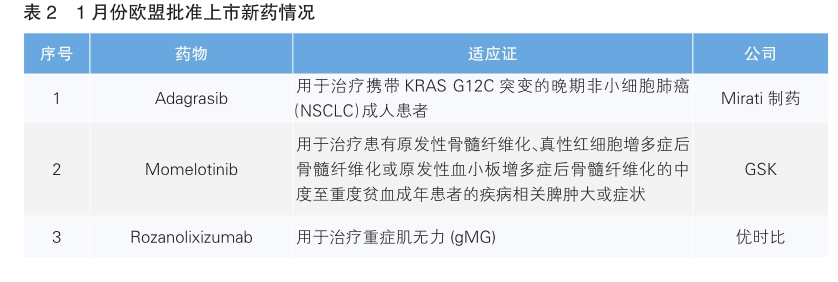
欧盟批准3款新药上市
1月份,欧盟批准了3款新药上市,根据Pharmadigger数据库,均非全球范围内首次批准(详见表2)。
Adagrasib(Krazati)是Mirati公司研发的一款高选择性和强效的KRAS G12C口服小分子抑制剂。该药此次获批主要基于名为KRYSTAL-1的Ⅱ期临床试验的积极结果。结果显示,在116名早前接受过铂类方案和免疫检查点抑制剂治疗的KRASG12C突变晚期非小细胞肺癌(NSCLC)患者中,有43%的患者获得疾病应答。Adagrasib已于2022年12月在美国获批上市。
Momelotinib(Ojjaara)是一款每日口服一次的JAK1/JAK2和激活素A受体1型(ACVR1)抑制剂。骨髓纤维化是一种罕见的血癌,由JAK信号转导器和转录蛋白信号激活剂失调引起,其特征是出现全身症状、脾肿大和进行性贫血。该药已于2023年9月在美国获批上市,用于治疗中度或高风险骨髓纤维化。
Rozanolixizumab(Rystiggo)是优时比研发的是一款皮下注射新生儿Fc受体(FcRn)靶向单抗,以高亲和力特异性结合人类 FcRn,通过阻断 FcRn 和IgG (致病性免疫球蛋白G)的相互作用,以加速 IgG 的分解代谢,用于治疗重症肌无力。该药已于2023年6月在美国获批上市。(陈倩)
(注:本文中的新药分别按中国、美国、欧盟三地新分子实体或生物药首次NDA/BLA来统计,一些药物首先在美国上市后首次在中国或欧盟上市时也会纳入统计)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:陆悦)
分享至
右键点击另存二维码!
-
为你推荐