2010-2019年六大监管机构新药审评情况分析【下】
- 2020-09-30 10:43
- 作者:
- 来源:科睿唯安
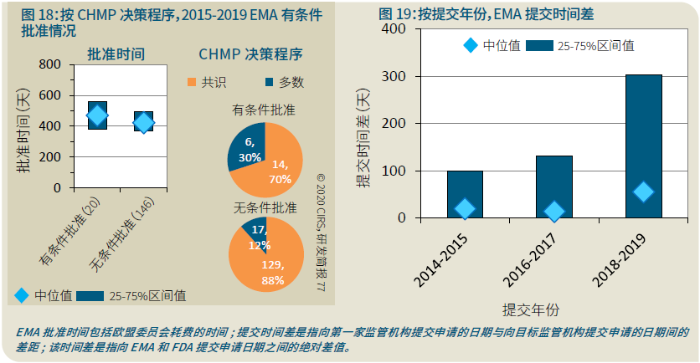
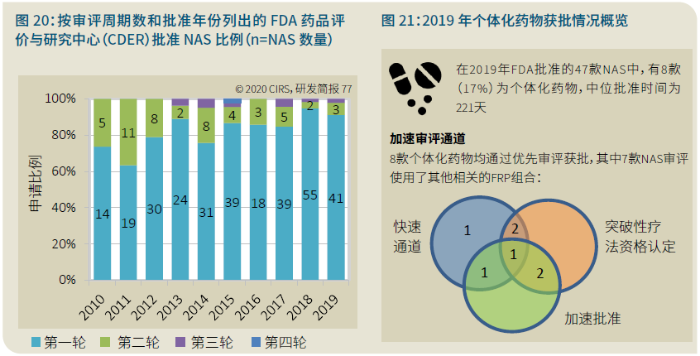
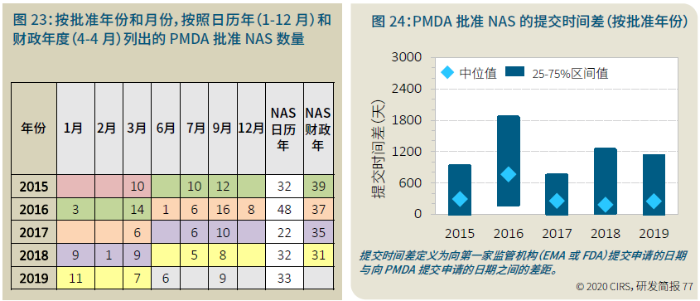
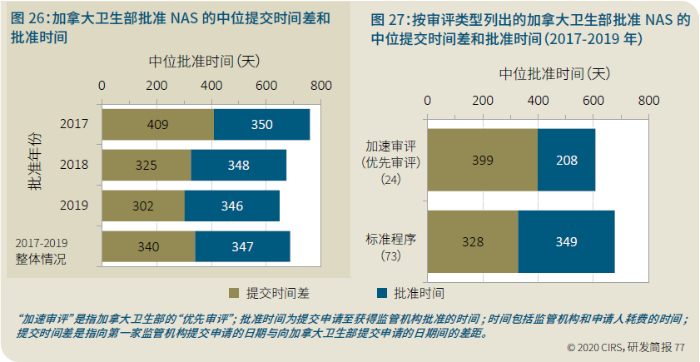
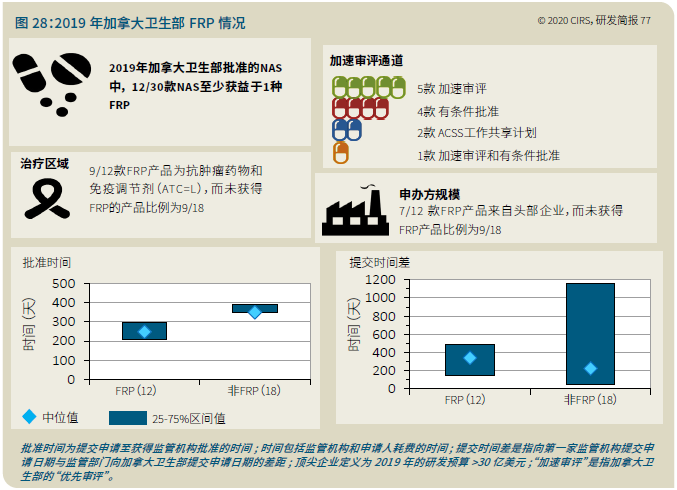
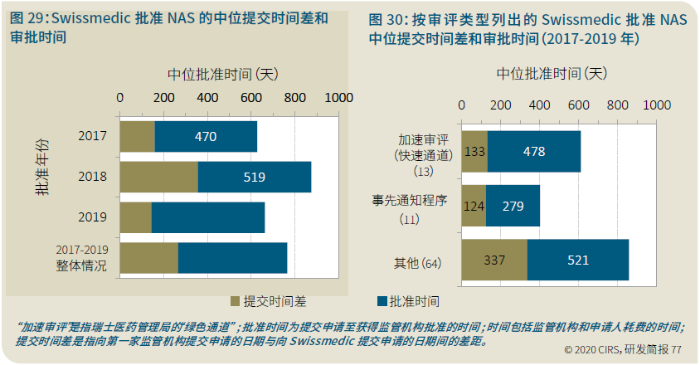
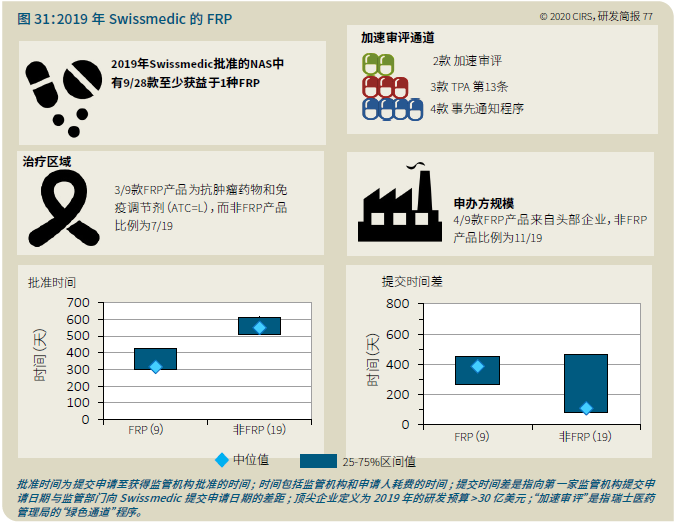
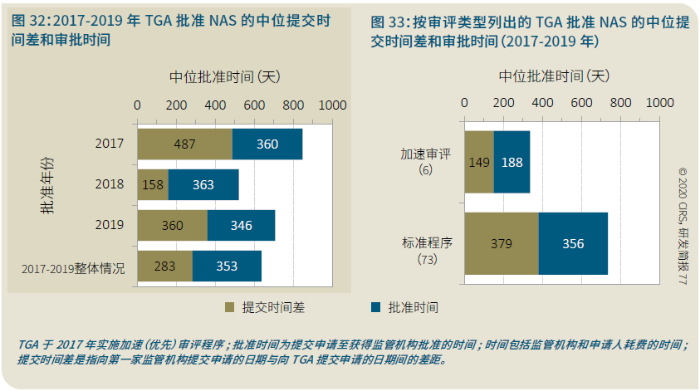
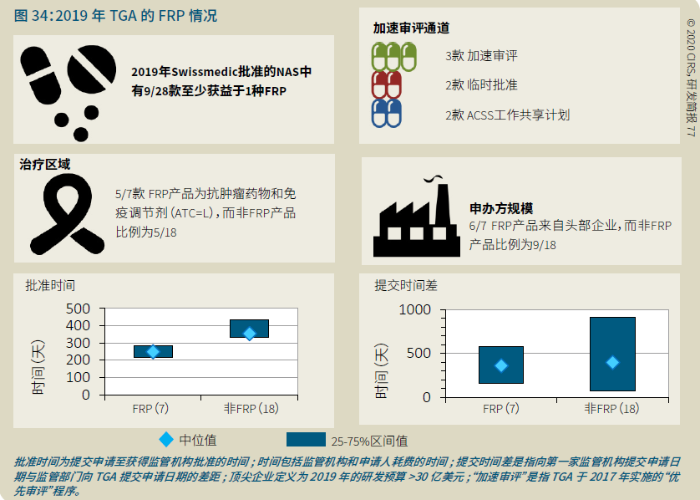
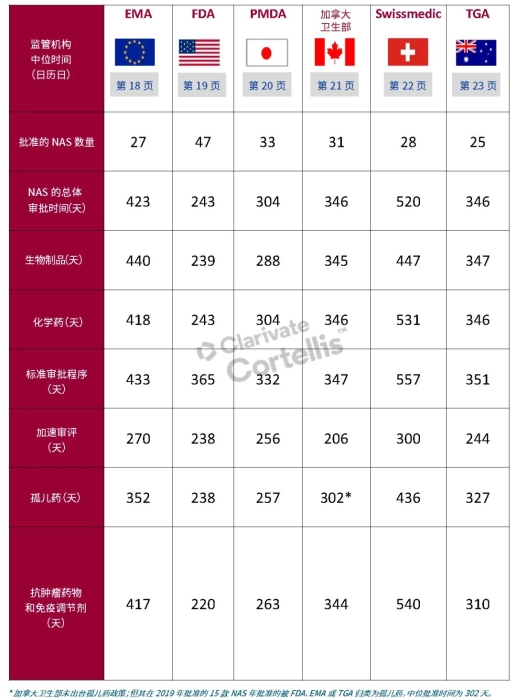
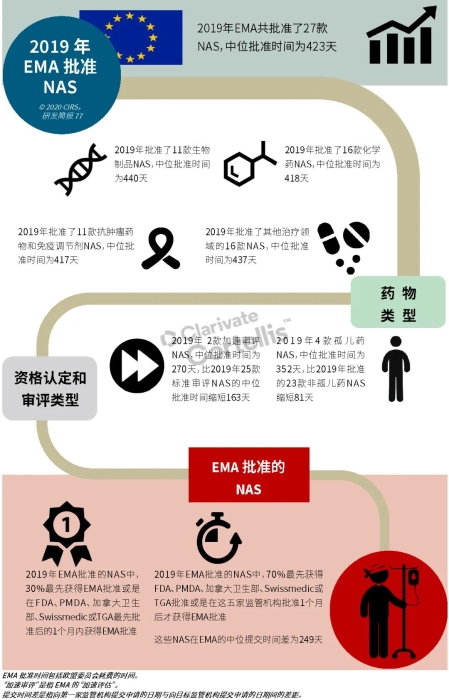
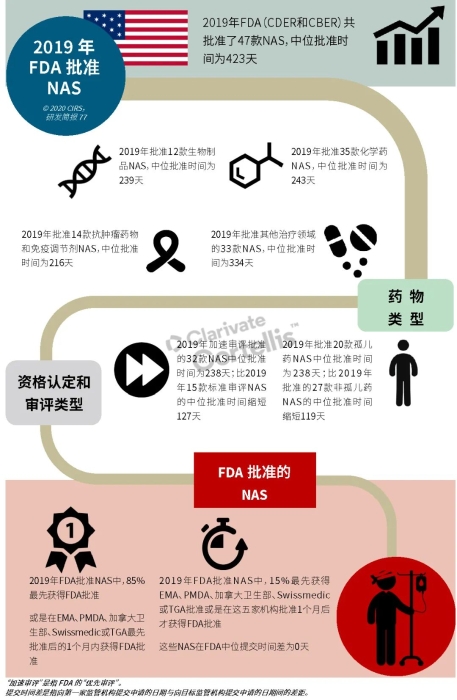
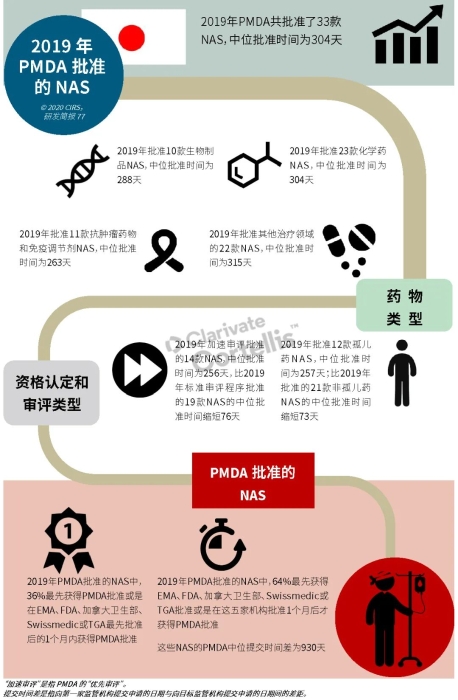
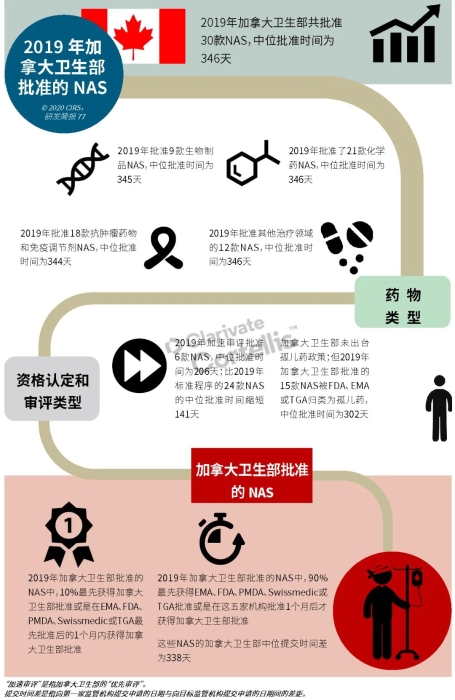
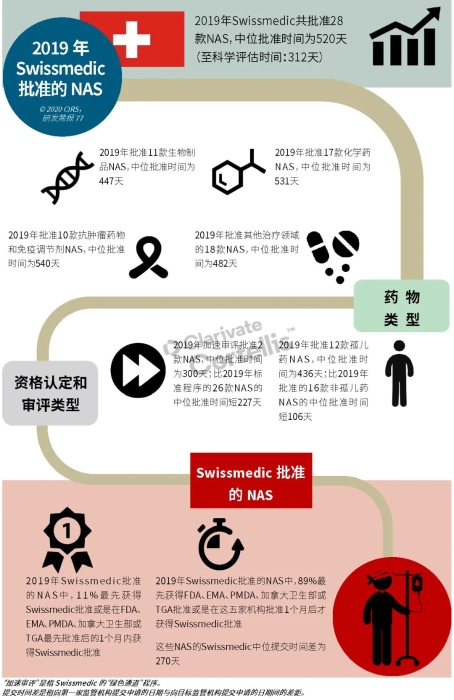
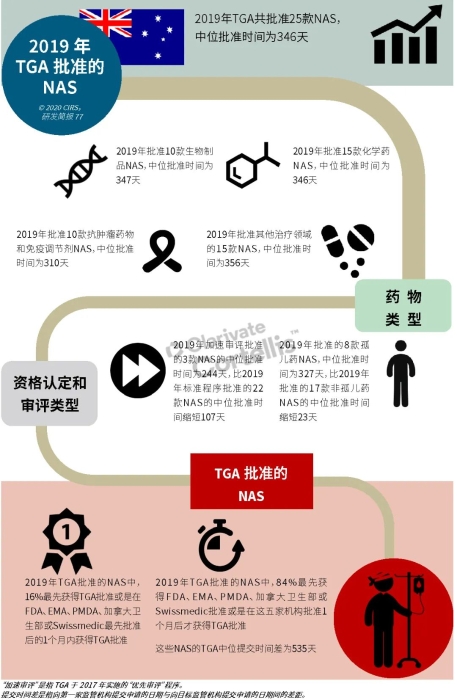
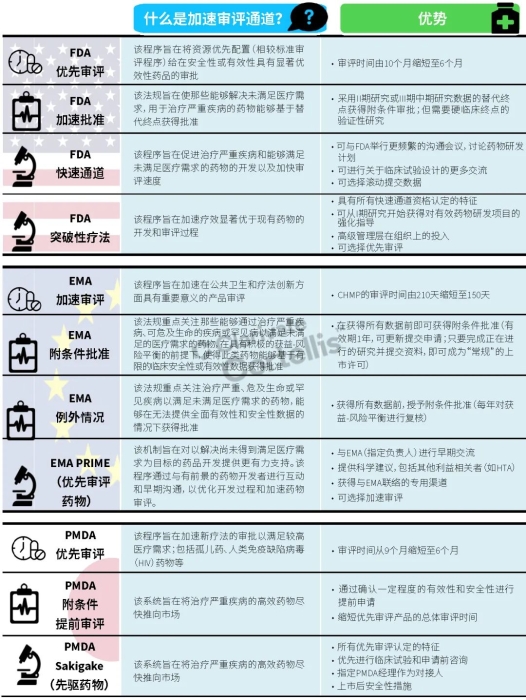
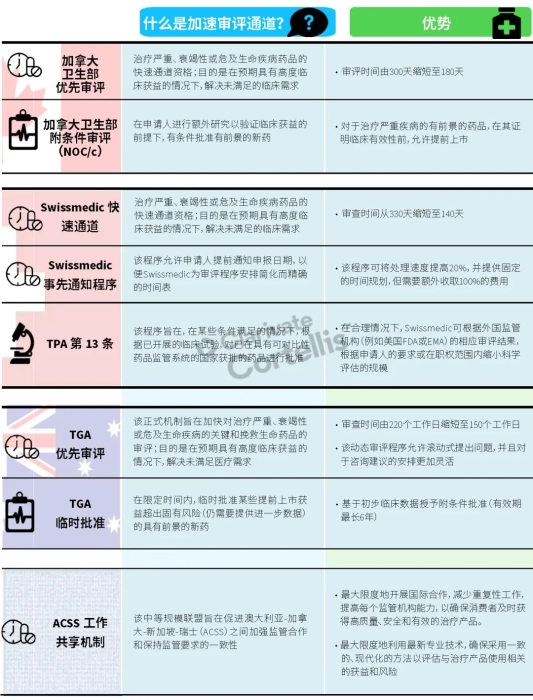
EMA审批程序特点 2018~2019年,EMA的企业回复时间或规定的中位停止时间与2015~2017年间相比增加了约1个月(图16)。2015~2017年间非头部企业获批的NAS数量约占所有批准总数的49%,但2018~2019年间的这一比例增加至57%。无论产品是通过达成共识还是多数同意获批(CHMP成员意见不统一时采取多数通过的方法),均可能对审评时间产生影响。与通过达成共识获批的产品相比,通过多数同意获批的产品的监管机构时间中位数增加了约14%,企业回复时间中位数增加了约61%(图17)。 对比分析2015~2019年EMA有条件批准与无条件批准情况发现,有条件批准的20款NAS与无条件批准的NAS相比,前者的中位批准时间更长(470天),而无条件批准中位时间为420天,多数同意批准的比例更高(30% vs 12%)。有条件批准程序在过去被用作补救程序;在2015~2019年间20款通过有条件批准获批的NAS中,仅有3款由CHMP提议,其余均由申办方提出申请。有趣的是,在分析提交给第一家监管机构至提交给EMA之间的提交时间差的变化时,数据显示,与2014~2015年及2016~2017年两个时间段相比,2018~2019年的中位提交时间差有所增加,提交时间差变化更大(图19)。 FDA审批流程特点 第一轮即获得FDA CDER批准的NAS比例从2010~2014年间的76%升高至2015~2019年的89%(图20)。第一轮获批的NAS数量增加表明申报资料的质量更高,这反过来又提高了审评效率。但是,需要注意的是,该分析仅对已获批的NAS进行了分析;如果纳入尚未获批的NAS则可能会获得不同的结果。在2019年FDA批准的NAS中,8款NAS为个体化药物(图21)。这些药物均通过优先审评获批,这表明它们具有前景,而且能够解决未满足的医疗需求,因此符合加速通道的要求。 2019年,FDA批准了15款BTD的NAS,均通过加速审评(优先审评)批准,其中53%由头部企业提交(图22)。在15款BTD的NAS中,7款为抗肿瘤药物和免疫调节剂。2015~2019年批准的BTD中,从IND到递交申请的开发时间缩短,这符合BTD预期获益。 PMDA审批流程特点 PMDA一般在每个财政年有4次药品批准,基于财政年度分析的PMDA批准数量在2015~2018年间出现同比减少(图23)。2019年,PMDA的提交时间差中位数为248天,比上一年多67天。近年来,通过政府项目和申办方的本地研发权等措施,日本患者对老产品的可及性已有所改善。 2017~2019年PMDA批准的3款NAS获益于先驱药物政策,这种资格认定使得创新药开发和获批成为可能。3款先驱药物的中位批准时间为181天,比非先驱药物快135天,而且先驱药物NAS没有中位提交时间差(图25)。 3款先驱药物NAS均已获得FDA批准,其中1款也已获得EMA批准。这些药物在上述两个机构均通过加速审评获批。其中2款为抗肿瘤药物和免疫调节剂,2款获得孤儿药资格认定。 加拿大卫生审批流程特点 2017年起,加拿大卫生部的中位提交时间差开始逐年缩短,2019年的中位提交时间差相较2017年缩短了107天(图26)。根据审评类型对2017~2019年总体提交时间差和审批时间进行了分析(图27)。加速审评(优先审评)NAS的中位批准时间较短,但对于中位提交时间差而言并非如此。 2019年加拿大卫生部批准的NAS中有40%至少获益于1种FRP,并且比其他NAS的审批时间快101天。在这12款NAS中,75%为抗肿瘤药物和免疫调节剂,58%来自头部企业(图28)。加拿大卫生部还在2019年通过ACSS联盟批准了2款NAS。 Swissmedic审批流程特点 2019年,Swissmedic的中位提交时间差缩短至143天,而2018年为355天。相反,中位批准时间几乎保持不变(图29)。对2017~2019年总体中位提交时间差和中位批准时间分析发现,加速审评(快速通道)的NAS或事先通知程序的NAS(图30)审批速度更快。 2019年,至少通过一种FRP获批的9款NAS的中位批准时间较非FRP的NAS缩短234天,但与非FRP产品相比,FRP的NAS提交时间差更长(图31)。2019年,3款NAS基于TPA第13条获批,Swissmedic通过该政策借鉴了国外监管机构的审评结果。与非FRP的NAS相比,使用至少1种FRP的NAS提交时间差滞后278天。 TGA审批流程特点 2019年TGA中位提交时间差增加至360天,2018年为158天。其中位批准时间相近,2019年缩短17天(图32)。2017~2019年TGA采用2017年引入的加速审评(优先审评)程序批准了6款NAS,中位批准时间为188天,比中位标准审评时间缩短了168天。加速审评的NAS中位提交时间差为149天,比标准审评程序缩短了230天(图33)。 2019年TGA批准的NAS至少获益于一种FRP,并且比非FRP的NAS批准时间缩短106天。FRP的NAS中位提交时间差比非FRP的药物短37天,且变化更小(图34)。TGA在2019年通过新引入的ACSS工作共享机制批准了2款NAS,加拿大卫生部也参与了对这些产品的审评。 2019年六大监管机构 批准NAS情况汇总 本表按产品类型、审评类型和主要治疗领域,对六大监管机构在2019年批准NAS的审批时间进行了汇总。 聚焦:EMA 2019 聚焦:FDA 2019 聚焦:PMDA 2019 聚焦:加拿大卫生部 2019 聚焦:Swissmedic 2019 聚焦:TGA 2019 加速审评通道(FRP) ICH的加速审评通道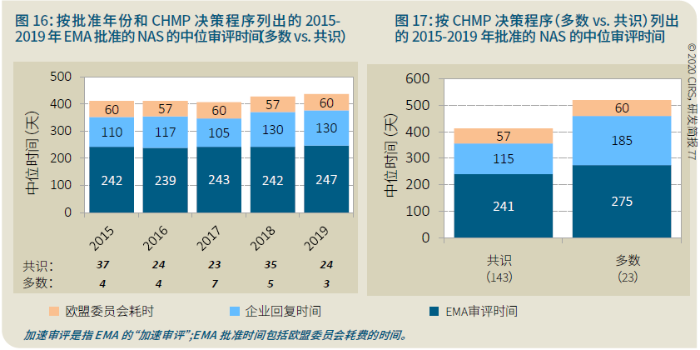


《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:刘思慧)
分享至
右键点击另存二维码!
-
为你推荐