曝光台|国家药监局通报安旭生物临床试验存在真实性问题 该企业已提交注册上市申请
- 2021-01-19 16:40
- 作者:满雪 闫若瑜
- 来源:中国食品药品网
中国食品药品网讯(记者满雪 实习记者闫若瑜) 1月15日,国家药品监督管理局发布公告,通报杭州安旭生物科技股份有限公司(以下简称安旭生物)生产的人类免疫缺陷病毒抗体/丙型肝炎病毒抗体/乙型肝炎病毒表面抗原/梅毒螺旋体抗体联合检测试剂盒(免疫层析法)(受理号:CSZ2000162),临床试验存在真实性问题。国家药监局作出不予注册,并自不予注册之日起一年内不予再次受理该项目的注册申请的处理决定。
国家药监局于2020年11月对在审的10个医疗器械注册申请项目开展临床试验监督抽查,涉及27家临床试验机构。检查发现,安旭生物生产的抗体联合检测试剂盒在浙江大学医学院附属第一医院开展临床试验中,医疗机构留档的电子照片拍摄时间、地点与临床试验实际时间、地点不一致,临床试验数据无法溯源。
针对上述问题,国家药监局根据《中华人民共和国行政许可法》第七十八条和《体外诊断试剂注册管理办法》第四十九条规定,对该注册申请项目不予注册,并自不予注册之日起一年内不予再次受理该项目的注册申请。同时,责成浙江省药监局切实履行对该公司和相关临床试验机构的属地监管责任,依法依规调查处理,并将调查处理结果报国家药监局。
针对国家药监局通报的临床试验真实性问题,记者多次致电安旭生物,但电话均未接通。
值得注意的是,本次在临床试验中数据造假的安旭生物还是一家科创板拟上市公司。
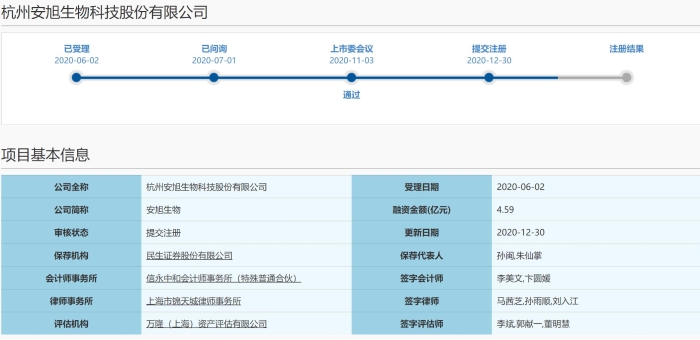
记者在上海证券交易所官网查询发现,安旭生物的科创板上市申请于2020年6月2日获受理,融资金额4.59亿元。2020年11月3日,安旭生物通过上市委会议。同年12月30日,安旭生物提交科创板注册,目前正在等待注册结果。
安旭生物2020年12月30日发布的招股说明书显示,公司成立于2008年,主营POCT(现场即时检测)试剂及仪器的研发、生产与销售,拥有抗原抗体自主研发生产的生物原料技术平台以及免疫层析及干式生化诊断技术平台,形成了覆盖毒品检测、传染病检测、慢性病检测、妊娠检测、肿瘤检测、心肌检测、生化检测、过敏原检测等八大领域的POCT试剂。
2017年至2020年上半年,公司实现营收分别为1.11亿元、1.64亿元、2.10亿元、3.08亿元,相对应的净利润分别为-579.15万元、3340.93万元、5444.76万元、1.72亿元。
2020年,在新冠病毒检测试剂出口带动下,安旭生物业绩大幅增长,公司2020年1~9月营业收入达到4.70亿元(经审阅),净利润2.50亿元(经审阅),分别同比增长203.82%、473.09%。
安旭生物招股书显示,该公司产品以外销为主,近4年的境外销售收入占比均超过93%。安旭生物称,公司已成为国内少数几家在POCT国际市场能够与跨国体外诊断行业巨头竞争的中国体外诊断产品供应商之一。
截至2020年12月30日,安旭生物取得国内第一类医疗器械备案凭证1个、国内第二类医疗器械注册证书20个、国内第三类医疗器械注册证书8个。此外,安旭生物取得美国FDA (510K)认证15个、202项产品的欧盟CE认证、加拿大MDL认证33个。
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:张可欣)
分享至
右键点击另存二维码!
-
相关阅读
- 曝光台|国家药监局通报安旭生物临床试验存在真实性问题 该企业已提交注册上市申请
- 康方生物-B:自愿公告-Cadonilimab(PD-1_CTLA-4双特异性抗体)在中国治疗复发或转移性宫颈癌的注册性II期临床试验提前完成患者筛选入组
-
为你推荐
-

-

互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有










