默示许可下,临床试验申请如何操作?
- 2018-11-13 10:00
- 作者:窦洁
- 来源:中国健康传媒集团-中国医药报
近日,药品审评中心(CDE)网站主页“热点栏目”新增“临床试验通知书发放目录”一栏。这标志着我国药品临床试验默示许可制顺利实施。
加快药品临床试验管理改革,调整优化临床试验审评审批程序,是药品审评审批制度改革的重点工作之一。今年7月,国家药监局发布《关于调整药物临床试验审评审批程序的公告》,就药物临床试验审评审批程序作出调整:在我国申报药物临床试验的,自申请受理并缴费之日起60日内,申请人未收到CDE否定或质疑意见的,可按照提交的方案开展药物临床试验。
在新规则下,企业申报临床试验应注意以下问题。
在CDE官网查询已默示许可品种
打开药审中心网站(http://www.cde.org.cn/),可以在“热点栏目”看到“临床试验通知书发放目录”一栏。点击进入,即可查询到已默示许可的品种。

进入“临床试验通知书发放目录”栏目可以看到,截至11月8日,已有19个受理号获得默许。其中不仅包括来自默沙东研发(中国)有限公司和艾伯维医药贸易(上海)有限公司等跨国制药企业的申请,也有来自和铂医药(广州)有限公司、无锡智康弘仁新药开发有限公司等国内制药企业的申请。
60日,自申请费用收到日开始计算
“自申请受理并缴费之日起60日内”中的 “60日”期限如何计算?
“60日”是从申请费用收到日开始计算,且是60个工作日。
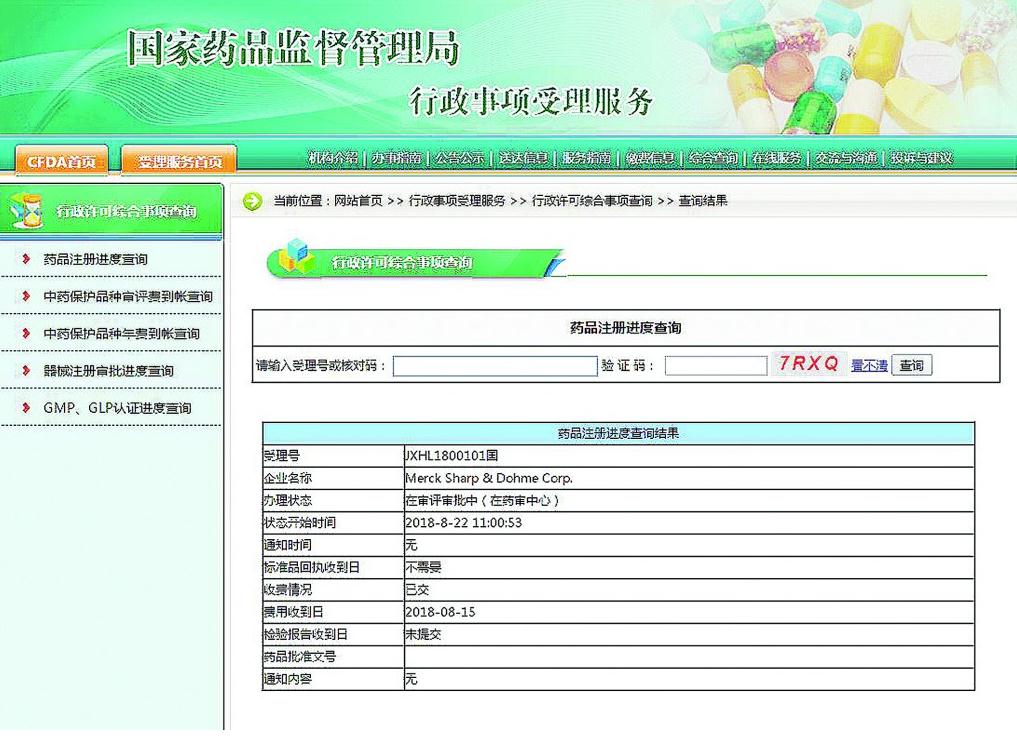
查询费用收到日,可以通过登录国家药监局网站(http://www.nmpa.gov.cn),点击“行政事项受理服务”栏目中的“行政许可综合事项查询”一栏进行查询。

11月8日,记者以受理号JXHL1800101为例进行查询操作。点击“行政许可综合事项查询”后,在上方“综合查询”-“药品注册进度查询”后的栏目中,输入“JXHL1800101”及验证码,点击“提交”即可。查询结果显示,该品种的申请费用收到日为2018年8月15日。
在查询界面下方,可以看到“使用说明”。
“使用说明”指出,药品注册进度查询系统可查询已受理品种的办理状态,申请人如果有疑问,可向受理申请的省级药监部门或国家药监局查询。
“使用说明”提到,申请人可按受理号进行查询,其中查询结果中“办理状态”有“待审评”“在审评”等10种情况。
企业应兼顾速度与质量
分析《关于调整药物临床试验审评审批程序的公告》可知,在临床试验申请中,有几个重要因素影响整个临床试验申请时长:是否为首次临床试验申请;申报资料是否符合审评技术要求;是否被暂停临床试验,常见于申报资料无法按时补充,存在重大缺陷,或临床试验方案不完整,或缺乏可靠的风险控制措施、存在潜在的临床风险而无法保障临床试验受试者安全;技术指南是否明确、药物临床试验是否有成熟研究经验;申请人是否能够保障申报资料质量;是否是国际同步研发的国际多中心临床试验申请;是否在监管体系完善的国家和地区已经获准实施临床试验。
由此可见,随着药品审评审批流程效率提高,企业在加快临床试验进程的同时,更要提高临床研究质量。临床研究申报流程与以往相比有极大不同,企业需先获得伦理批件,再向药审中心提交临床试验申请,这意味着企业的相关准备工作要提前,包括临床前研究的安排、临床研究单位的选择、临床试验方案的准备等。(记者 窦洁)
《中国医药报》社版权所有,未经许可不得转载使用。
(责任编辑:)
分享至
右键点击另存二维码!
-
相关阅读
-
为你推荐
-
吉林召开仿制药一致性评价工作座谈会
吉林省共有29家企业的76个批准文号(其中基药目录品种50个文号、非基药目录品种26个文号)开展仿制药一致性评价研究,现已有2个品种进入《中国上市药品目录集》。 2019-07-22 13:39 -
互联网新闻信息服务许可证10120170033
网络出版服务许可证(京)字082号
©京公网安备 11010802023089号 京ICP备17013160号-1
《中国医药报》社有限公司 中国食品药品网版权所有









